產志賀毒素大腸桿菌(STEC)具有很強的致病性,全球范圍內由其引發的食物中毒和其他公共衛生事件呈逐年升高之勢,嚴重威脅人類的健康。開發快速可靠的檢測手段對其引發的食源性疾病的監測、控制和預防意義重大。本文結合對STEC分子生物學特征的研究,著重介紹了多重PCR檢測技術在檢測食品中STEC方面的應用。
食源性疾病是當今世界上最廣泛的公共衛生問題,其中細菌性疾病以產志賀毒素大腸埃希氏菌(STEC)引起的出血性結腸炎(HC)、溶血尿毒綜合征(HUS)和血小板減少性紫癜(TTP)最為嚴重,因此STEC又稱腸出血性大腸埃希氏菌。志賀毒素(STX)對Vero細胞有細胞毒作用,所以STX也叫做Vero毒素(Vero Toxin,VT),STEC也因此被稱為VTEC。
自從STEC首次被確認為人類致病菌以來,許多國家由STEC引起的食源性感染的發生幾率大幅提高。一方面是由于對STEC認識的逐步深入,另一方面是由于STEC引發的臨床疾病死亡率較高。STEC有100余種血清型可產生志賀樣腸毒素(如O26、O45、O48、O103、O111、O113、O121、O128、O145、O157和O163等),其中最常見的就是O157:H7。STEC主要寄居在動物腸道中,致病性強,先后在 40 多個國家引發了不同程度的流行病,是世界范圍內最危險的食源性致病菌之一。

食品中STEC檢測的挑戰
從多種類型的食品中檢測并分離STEC是一項具有挑戰性的工作。一方面是因為食品樣品中的STEC污染量可能較低,對方法的靈敏度具有較高的要求;另一方面,食品中的STEC往往受到加工的影響而處于受損狀態(如酸性、受熱、冷凍、高鹽、抗生素環境),復雜的競爭菌群和食品成分會對STEC的檢測產生抑制,因此對方法的特異性和抗干擾能力提出了更高的挑戰。
傳統的STEC檢驗方法包括營養培養、菌落選擇、生化反應特性和志賀毒素檢測。由于大腸桿菌O157:H7具有獨特的生化特性較易分離,但非O157-STEC的表型卻較為復雜和多變,這是采用傳統方法開展非O157-STEC檢驗的最大難題。現已發現STEC存在許多變異株,任何單一方法的檢測都可能存在缺陷,如發酵山梨醇的變異株用SMAC培養基就無法分離出來;許多其他菌,如腸致病性大腸桿菌(EPEC)、志賀氏菌、霍亂弧菌也可能產生STX,單純檢測stx基因可能帶來假陽性結果。因此靈敏度較高,結果更為準確,重現性較好的基于多重PCR檢測的方法受到了越來越多的關注。
建立多重PCR檢測方法
多重PCR作為傳統PCR的擴展和補充,采用多組引物,可在同一個PCR反應中同時擴增多個目標片段進行檢測,相比傳統PCR可提供更多的基因信息,因此非常適合復雜的STEC血清型的檢測和確認。
STEC的毒力是由多因子決定的,其致病的特征性毒力因子是STX1和STX2,分別由stx1基因和stx2基因編碼。因此stx1和stx2是最為經典的多重PCR檢測的目標基因。其他毒力因子,如由eae基因編碼的緊密素和hly基因編碼的溶血素等也是重要的毒力因素,已被作為多重PCR檢測的靶序列,用于STEC的特征性鑒定和對潛在的致病性作出前瞻性判定。除了上述4種常見的目標基因之外,還有許多保守序列已被應用到STEC的多重PCR檢測中,如uidA、fliC、rfb、ehxA、wzx、wbdI、ihpl和wzy等。
由于食品中的某些成分常常對Taq聚合酶具有抑制作用(如肉制品中的脂類成分等),從而會影響PCR方法的靈敏度,因此在方法開發的過程中應充分考慮這些因素。通常的做法是從食品樣本中分離出STEC進行檢測,或進行樣品稀釋,或在PCR試劑中加入某些成分中和抑制,或從增菌液中抽提核酸來消除這些抑制因素的影響。對于食品中的其他菌群的干擾,可以采用酸化的方法進行處理,因為許多STEC對酸性環境都表現出了較好的耐受性。
美國一項長達19年的研究顯示:約70%的STEC感染是由6種主要的血清型(O26、O45、O103、O111、O121和O145)引發的。為此,美國農業部(USDA)于2011年9月宣布對這6種非O157型STEC進行檢測,“零容忍”受污染食品,并于2012年6月公布了MLG 5B法案,采用自主設計的引物和探針對肉制品中的STEC進行PCR快速檢測和確認。USDA農業研究司還與美國杜邦公司簽署了一項合作研究和開發協議,將針對6大STEC血清型的多重實時PCR檢測技術予以商業化。合作研究包括增菌方法的考量,多重PCR條件的優化以及疑似陽性樣本的確認方法。
USDA與杜邦BAX系統的STEC多重PCR檢測方法均分為兩大步。首先以毒力基因stx(包括stx1和stx2)及eae為目標基因,初篩肉制品中的STEC;然后,初篩陽性的樣本(stx與eae均呈陽性的樣本)再以與O抗原簇相關的保守序列(如wzx、wbdI和16S RNA等)為目標基因繼續篩查特定的STEC血清型。該技術路線和檢測策略同樣也被法國食品安全局和歐洲標準委員會所推薦。
杜邦公司分別于2010年和2011年推出了大腸桿菌O157:H7和STEC多重實時PCR檢測試劑盒。這兩種試劑盒能與杜邦的BAX System全自動病原微生物快速檢測系統配套使用,可快速、準確、標準化地檢測食品中的O157和非O157型STEC,并可進一步篩查MLG 5B法案所規定必檢的6大非O157 STEC血清型。BAX系統已經通過了美國官方分析化學家協會和法國標準化委員會的驗證。
為了進一步實現BAX系統O157:H7和STEC檢測方法的標準化、一致性和高效率,提升用戶的使用體驗,在方法的設計之初,科研人員就已充分考慮各種因素,如增菌培養基、溫度、時間、裂解酶、抗PCR抑制、DNA聚合酶、PCR程序、引物及探針的選擇和設計等等。進行BAX檢測時,多種食品樣品均可采用TSB一步增菌(只需9h),無需IMS富集和核酸抽提,僅需使用相同的裂解酶熱處理即可,樣品處理的步驟也大大簡化。PCR檢測程序的標準化使得裂解產物可在同一批次的反應中同時進行多種STEC血清型的檢測和確認,效率和靈活性也因此得到大幅提升。多重PCR檢測還采用了Scorpion探針技術,檢測的效率、靈敏度、準確性和特異性因此獲得了更好的提升。
BAX STEC檢測法也與USDA的MLG 5B方法保持了高度的一致性,并于2012年6月通過了USDA食品安全檢驗局的認證,可與USDA的方法可等同使用。BAX方法無需IMS富集和核酸抽提,藥片化的試劑已經預裝了PCR所需的全部試劑,包括引物、DNA聚合酶、陽性內參和脫氧核苷酸等,保質期長達3年,檢驗過程也十分簡單,PCR反應程序均為內設,結果也采用自動分析,可最大程度地減少主觀因素和交叉污染,提升穩定性和重復性,對食品中的背景菌和抑制因子也有較好的抗干擾作用,較常規的PCR檢測具有更為突出的優勢。
多重PCR檢測的驗證與比較
材料與方法
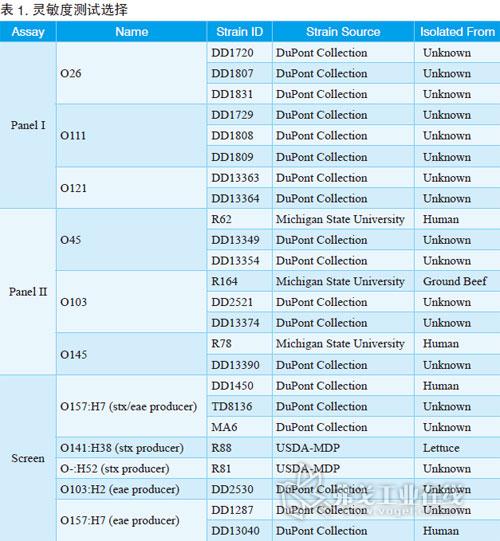
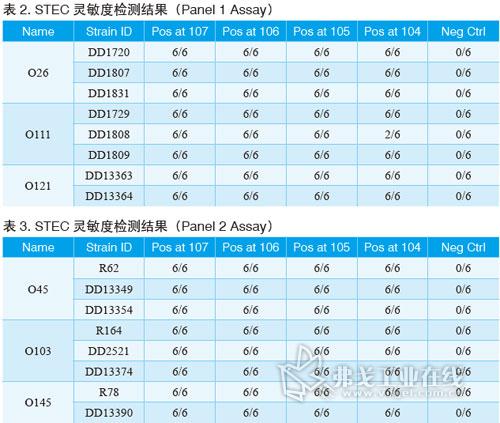
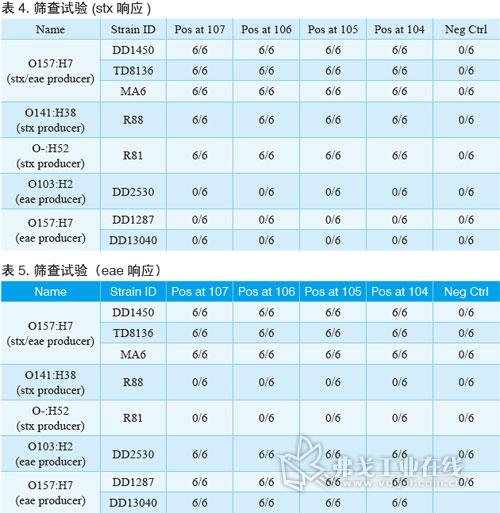
BAX系統STEC檢測試劑盒;Screen(篩查)試劑盒;Panel I試劑盒(確認E.coli O26、O111和O121);Panel II試劑盒(確認E.coli O45、O103和O145);BAX全自動病原微生物快速檢測系統;TSB肉湯;BHI肉湯。菌株選擇請見表1。
檢測方法
將菌劃線至BHI瓊脂上,選取一個菌落接種到BHI培養基中41℃下孵育過夜。接著將培養基梯度稀釋,每個梯度將20μl的樣品加入到200μl的裂解液中,并于37℃下加熱20min,然后在95℃加熱10min,在冷卻模快下冷卻至少5min。最后,將30μl的溶菌液加入到含有PCR藥片試劑的管子中,并放入BAX系統中運行即可。
結果
經過驗證,BAX系統STEC檢測試劑盒對代表菌株的檢測靈敏度能低至增菌后104cfu/ml。
小結
強致病性的STEC已成為繼沙門菌和彎曲菌之后的第三大流行菌群,開發快速可靠的STEC檢測手段十分必要。食品中的STEC由于其較低的致病量,較低的污染水平以及復雜的血清型,一直是檢測的難點。傳統的表型、生化和免疫的方法均無法有效地將食其從高污染水平的競爭菌群中篩查出來。而多重PCR檢測手段,因其針對STEC特有的多個毒力基因為檢測目標,有著較高的靈敏度和準確性,在STEC快速檢測方面有著十分光明的應用前景。