近年來隨著現代醫學研究技術的進步和CTC臨床應用價值凸顯,許多研究機構和研發團隊都在推出不同的CTC檢測技術。由于血液中CTC的含量極低,目前主流的檢測方法是先捕獲(富集)后檢測,少量方法是不捕獲(富集)直接檢測。CTC檢測技術包括CTC的富集(分離)和CTC的分析鑒定(識別)。本篇文章將介紹CTC的富集和分析方法,尤其重點介紹CTC的富集方法。
一CTC富集方法的分類和原理
人體循環系統中CTC的含量極低,腫瘤轉移患者每毫升全血中僅有1~10個CTC,因此要實現CTC的檢測對其進行分選富集是一個關鍵的步驟。CTC分選富集效果的優劣將會直接影響其后續的檢測效果,因此高純度、高靈敏性(不丟失CTC)、快速、高細胞活性的CTC分選富集是CTC臨床應用的重點和難點。
CTC的富集方法可以分為生物化學特性富集法(親和性富集法)和物理特性富集法。親和性富集法主要是根據通過細胞表面特異性表達的蛋白質生物標志物分離靶細胞,包括正向捕獲CTC的陽性富集法和負向去除白細胞的陰性富集法。物理特性富集法主要是根據CTC的大小、密度、力學和介電性能等物理特性將CTC篩選出來。
1.1 親和性富集法
親和性富集法根據結合的靶細胞是CTC還是白細胞,可分為陽性富集法和陰性富集法。陽性富集法主要利用特異性抗體與腫瘤細胞表面抗原進行特異性結合來富集CTC。CTC分為上皮細胞表型、間質細胞表型和上皮間質細胞混合表型,因此用于CTC陽性富集的特異性抗體分為識別上皮標志物、識別間質標志物和識別上皮間質標志物三種。其中,上皮標志物在正常上皮細胞和上皮腫瘤(即癌)上表達,但在間質白細胞上不存在,因此經常用于區分癌細胞和正常血細胞。上皮細胞粘附分子(EpCMA)是最常用于上皮表型CTC陽性富集的細胞表面標志物。此外,由于細胞骨架蛋白對于上皮細胞具有特異性,細胞角蛋白家族成員(即CK8,CK18和CK19)已經成為檢測具有上皮表型癌癥患者CTC的“金標準”標記物。陰性富集法也稱白細胞去除法,通常用識別CD45或CD14的特異性抗體與白細胞結合,從而去除全血中的白細胞。
除了特異性抗體,親和性結富集法的某些技術采用與CTC或白細胞表面抗原特異性結合的多肽或適配體(aptamer,一種單鏈DNA或RNA分子,與目的蛋白有很高的親和力和特異性)替代抗體來實現陽性或陰性富集。
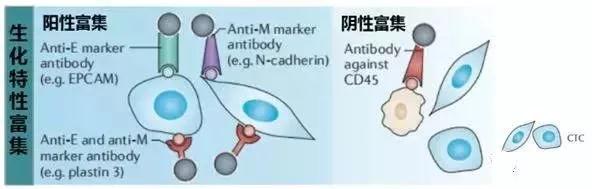
生化特性富集法
資料來源:NatRev Cancer. 2014 Sep;14(9):623-3
1.1.1 免疫磁珠技術
親和性富集法目前基于免疫磁珠技術和微流控芯片技術對CTC進行富集。免疫磁珠技術是根據免疫親和的原理,將免疫磁珠與捕獲抗體或特異性多肽(可與血液中的CTC或白細胞表面抗原相結合)相連接,隨后通過磁場即可將磁珠捕獲與未捕獲的細胞分離。
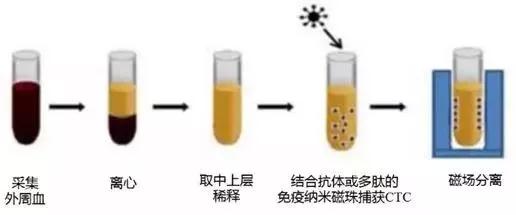
基于免疫磁珠技術的親和性富集法的原理
1.1.2 微流控芯片技術
微流控(microfluidics)是一種精確控制和操控微尺度流體,以在微納米尺度空間中對流體進行操控為主要特征的科學技術。微流控芯片是微流控技術實現的主要平臺和技術裝置,因其樣品量小、流速可控及構件透明性等特點,已被廣泛應用于CTC的分選富集中。微流體芯片技術基于親和性富集法分離CTC時,芯片內部的微通道或微結構上修飾能夠與CTC或白細胞表面抗原結合的特異性抗體或適配體,當血液流經芯片時,特異性抗體或適配體可與目的細胞表面抗原結合,隨后將CTC或白細胞粘附在芯片上,實現CTC的陽性捕獲或陰性富集。
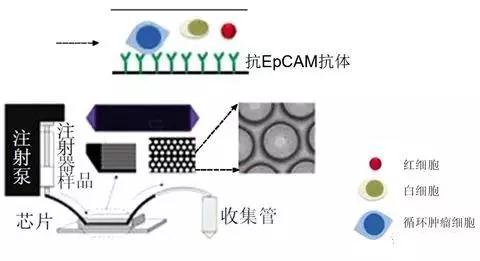
基于微流體芯片技術的親和性富集法的原理
資料來源:生物化學與生物物理進展2015,42(4): 301~312