(三)病原微生物檢測
病原微生物檢測主要包括病原鑒定和藥物敏感性判定兩個方面。目前,臨床微生物檢測面臨的最大問題就是檢測周期過長。感染性疾病大多病情兇險,需要及時診斷和治療,留給病原檢測的時間窗口只有30分鐘左右。然而,目前的病原微生物鑒定和藥物敏感性判定的典型周期是2-3天,這顯然難以滿足臨床需求。病原檢測技術的限制所帶來的結果是,一方面經驗性診斷的準確性難于保證,另一方面抗生素濫用引發了嚴重的耐藥問題。
微流控技術對于病原微生物鑒定的解決方案多是采用核酸檢測策略,這在前面部分已經敘述。鑒于藥物敏感性(Antimicrobial Susceptibility Testing, AST) 判定的實質是病原在藥物暴露條件下的增殖情況判定,微流控技術采用的策略是:1.通過培養器體積的減小,實現檢測信號的相對富集;2.使用更為精準的病原定量技術。這兩種策略均可以通過縮短病原培養時間實現快速的藥物敏感性判定。遵循這種理念,作者課題組發展了一種基于液滴陣列微流控芯片的數字化抗生素敏感性測試方法[11]。我們的設想是借助于數字化分析的精準定量能力顯著縮短細菌培養時間。細菌懸液與抗生素孵育后引入微流控芯片完成液滴發生和捕獲,生成高密度微液滴陣列。通過對液滴陣列進行熒光掃描成像,檢測每個液滴中的熒光信號并以此計算出細菌存活率(v)和陽性微液滴比例(p)。根據陽性微液滴比例,可以泊松分布算法推算出細菌密度,依據細菌密度變化可確定最小抑菌濃度(minimuminhibitory concentration, MIC)。我們的初步研究結果顯示應用該方法僅需30 min抗生素暴露時間即可判定大腸桿菌的抗生素敏感性。
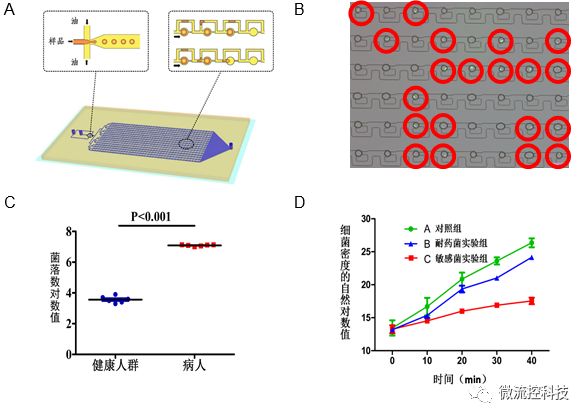
圖3A.液滴微流控芯片原理設計圖結構包含上游的液滴生成區和下游的液滴捕獲區;B.利用液滴熒光成像分辨細菌陽性和陰性液滴;C.液滴數字化分析顯示健康人和尿路感染病人尿液細菌計數差別;D.液滴數字化分析顯示敏感和耐藥細菌對于抗生素的反應。
(四)細胞水平抗腫瘤藥物敏感性測試
體外抗腫瘤藥物敏感性測試是指導抗腫瘤藥物合理使用的有效手段。雖然基因檢測可以用來預測抗腫瘤藥物敏感性,然而該方法存在一定的不確定性。相比之下,細胞水平的藥物測試仍然是判定抗腫瘤藥物敏感性更為直接可靠的手段。然而,由于細胞水平抗腫瘤藥物敏感性測試存在體內外實驗結果差異大、測試通量有限以及操作難于標準化等問題,至今在臨床難以推廣。
針對該問題,課題組開發了一套微流控腫瘤微陣列藥物測試系統[12],其核心是一種復合式結構開放式微流控芯片。芯片頂層是開放式儲液池,底層是細胞培養池陣列,中間層是納米孔薄膜。利用納米孔薄膜不允許液體通過只允許跨膜擴散的特性,將其用做止流閥實現細胞懸液自動分配以及用作擴散屏障仿真血管內皮層。配合移液工作站,這種微流控芯片可以實現藥物篩選所包含的長期細胞培養、換液、多藥物處理以及細胞存活檢測等一系列操作步驟。
研究利用自行設計加工的1010微流控細胞培養陣列芯片,實現了細胞培養陣列構建、長期細胞培養、換液、多藥物處理以及細胞存活檢測等一系列功能。乳腺癌細胞在持續培養3天后增殖形成了類組織結構。利用開放式微流控組織陣列芯片實現了3因素3水平正交藥物組合測試,并依據細胞存活率檢測結果篩選出最佳的抗乳腺癌藥物組合。研究結果顯示這種明微流控芯片能夠以高度仿真的組織實現多藥組合測試,因而有潛力成為指導腫瘤個體化精準治療的有力工具。
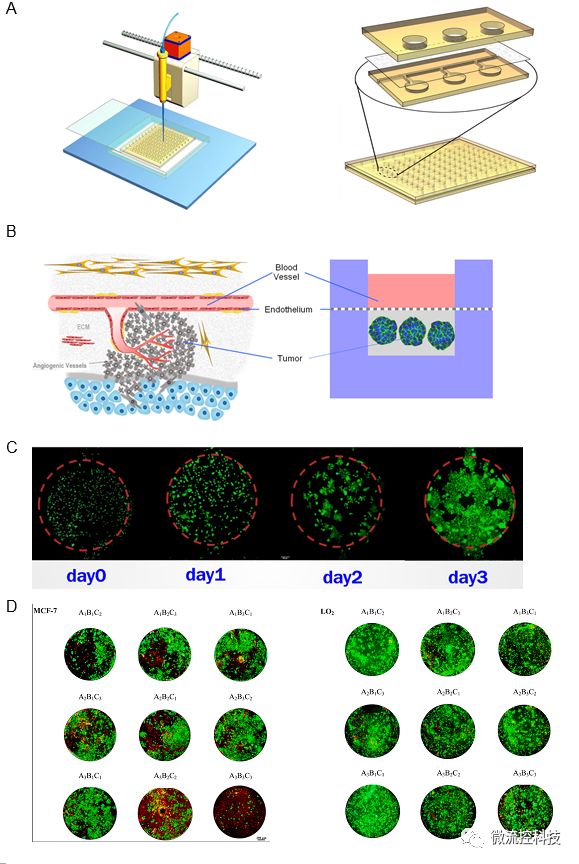
圖4A.微流控腫瘤微陣列藥物測試系統包含一種復合式結構開放式微流控芯片以及移液工作站;B.微流控芯片上腫瘤微環境重建的示意圖。3D培養腫瘤細胞模擬腫瘤實質,水凝膠模擬支持和滋養腫瘤細胞的腫瘤基質,納米孔薄膜擴散屏障模擬血管內皮層;C.微流控芯片上連續三天內MCF-7乳腺癌細胞增殖情況。(Calcein-AM / EthD-1染色,比例尺:200 μm);D.抗腫瘤藥物正交組合測試結果。藥物測試包括LO2肝細胞和MCF-7乳腺癌細胞對A.阿霉素,B.紫杉醇和C.順鉑的3因素3水平正交組合藥物的反應。
通過上述應用實例,我們將微流控體外診斷技術的優勢概括為:1.應用場景的拓展;2.分析效率的提高;3.分析時間的縮短以及4.檢測精度的提升。由此可見,微流控芯片是極具優勢的體外診斷技術平臺。
四、微流控體外診斷技術的機遇與挑戰
目前,我國正處于巨大的社會變革過程,一方面國力的增強和科技的進步促進了新技術的發展和推廣,另一方面新形勢對于體外診斷行業提出了新的要求。體外診斷作為一個高附加值行業,將會在未來相當長的階段中快速發展,甚至成為國家的支柱產業。隨著醫療改革的推進,三級醫療體系將逐漸完善,隨之而來的是醫療資源由集中轉變變為分散模式。公立醫院的改革以及第三方檢驗機構的興起,勢必會對體外診斷技術提出更高的要求。在這種形勢下,微流控技術將會對體外診斷行業的發展提供一個有利的契機。
現實中的微流控技術產業進程仍然是步履艱難。從技術角度來看,微流控體外診斷產品開發涉及多個學科領域,包括醫學、生物、化學和工程等。任何一個企業,想要建立這樣一個規模的研發隊伍都絕非易事。作為微流控系統的核心,微流控芯片的設計、材料選擇、表面處理、芯片加工乃至包裝保存,都具有一定技術難度。因此,微流控產品的研發難度遠遠高于傳統體外診斷產品。從產業環境角度來看,研究、生產和應用單位的脫節,高端加工技術的欠缺都增加了微流控產品開發的難度。此外,近期實體經濟的低迷也導至企業對于這種高技術含量產品研發信心不足。對于微流控體外診斷產品開發,我們認為以下幾個方面需要關注:首先是明確的市場定位,相比較傳統技術,微流控產品必須在某個應用領域或應用場景下具有突出的優勢;其次是前期研究基礎。由于微流控產品研發技術門檻較高,缺少扎實的研究基礎會增加開發進程的不確定性;再者就是盡量規避技術制約。由于各種條件限制,某些類型芯片可能在一定階段內不具備量產可行性。因此,我們對于微流控診斷產品開發的建議是:1. 選擇恰當的應用對象;2.整合研發資源;3. 開拓創造性的產學研合作模式。
五、結語
總體看來,微流控體外診斷技術的發展前途是光明的,道路是曲折的。無論如何,我們堅信微流控技術是新形勢下應對臨床檢驗醫學挑戰的有力工具,該技術勢必會對臨床檢驗能力的提升起到巨大的推動作用。
參考文獻:
[1]. 方肇倫,微流控分析芯片發展與展望. 大學化學, 2001,02:1-6.
[2]. 林炳承, 微流控芯片實驗室及其功能化. 中國藥科大學學報,2003. 34: 第1-6頁.
[3]. Whitesides,G.M., The origins and the future of microfluidics. Nature, 2006. 442: 368-373.
[4]. 林炳承, 功能型微流控芯片實驗室的高通量和規模集成. 高等學校化學學報, 2004. 25: 121-123.
[5]. Haeberle,S. and R. Zengerle, Microfluidic platforms for lab-on-a-chip applications. Lab Chip, 2007. 7: 1094-1110.
[6]. 林炳承, 微流控芯片的研究及產業化. 分析化學,2016. 44: 491-499.
[7]. 林炳承,秦建華, 微流控芯片實驗室及其應用出口:疾病診斷和藥物篩選, 第四屆全國微全分析系統學術會議,2007: 大連. 6-7.
[8]. Schulte,T.H., R.L. Bardell and B.H. Weigl, Microfluidic technologies in clinicaldiagnostics[J]. Clin Chim Acta, 2002. 321: 1-10.
[9]. Yager,P., et al., Microfluidic diagnostic technologies for global public health[J]. Nature, 2006. 442: 412-418.
[10]. Shu, BW, et al. Active droplet-array (ADA)microfluidics enables multiplexed complex bioassays for point of care testing. Chem. Commun., 2018. 54:2232-2235.
[11]. 梁廣鐵,杜燕,舒博文,等. 液滴陣列微流控芯片上的數字化抗生素敏感性測試.// 中國化學會,沈陽,東北大學,2017,第十一屆全國微全分析系統學術會議,沈陽:2017:1-1.
[12]. Lin D, et al. Orthogonal screening of anticancerdrugs using an open-access microfluidic tissue array system. Anal Chem. 2017; 89(22):11976-11984.