三、急性出血性凝血功能障礙的診斷
專家意見5 推薦采用四分類法診斷急性出血性凝血功能障礙。
目前急性凝血功能障礙沒有明確統一的診斷標準,病史、誘因和實驗室檢查異常是主要的診斷依據。急性凝血障礙是一種病理生理狀態,很多疾病會產生相似的實驗室結果異常。為了便于病因鑒別和疾病管理,Hunt將凝血障礙分成四類:(1)
血小板減少、凝血功能正常,血涂片沒有破碎紅細胞;(2) 血小板減少、凝血功能正常,血涂片存在破碎紅細胞;(3)血小板減少,存在凝血障礙;(4)
血小板正常,存在凝血障礙。
第一類指各種原因引起的血小板減少癥。第二類通常見于血栓性微血管病,比如血栓性血小板減少性紫癜 /
溶血尿毒綜合征。第三類指造成凝血因子大量消耗的疾病,比如
DIC。第四類指引起凝血因子生成減少或者抑制凝血因子的疾病,比如肝衰竭、口服抗凝藥。結合病史和臨床表現,這種分類方法在臨床上能幫助醫生確定病因和診斷。
專家意見6 推薦采用 ISTH DIC 評分法診斷 DIC 相關的凝血功能障礙。
DIC診斷需結合患者的基礎疾病、臨床表現、實驗室檢查,進行綜合評估。近年,國際血栓與止血協會標準(ISTH)、日本衛生福利部標準
(JMHW)、日本急診醫學學會標準 (JAAM) 以及中華醫學會血液學分會血栓與止血學組 (CDSS) 都制定了多指標的 DIC
評分診斷系統。本共識主要參考 ISTH DIC 評分 (表1)。
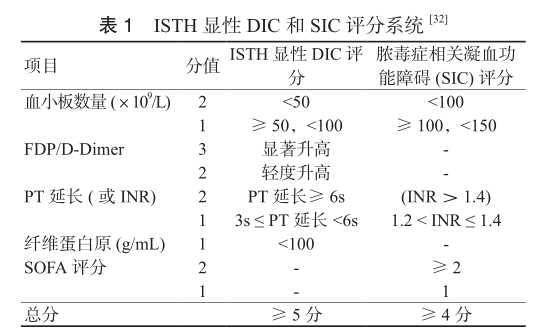
DIC前期 (pre DIC) 指出現某些 DIC 的臨床表現和(或)實驗室檢查指標,但未達到診斷標準的代償狀態(評分<5 分)。顯性 DIC 指患者已處于失代償期,即臨床典型 DIC(評分≥ 5分)。
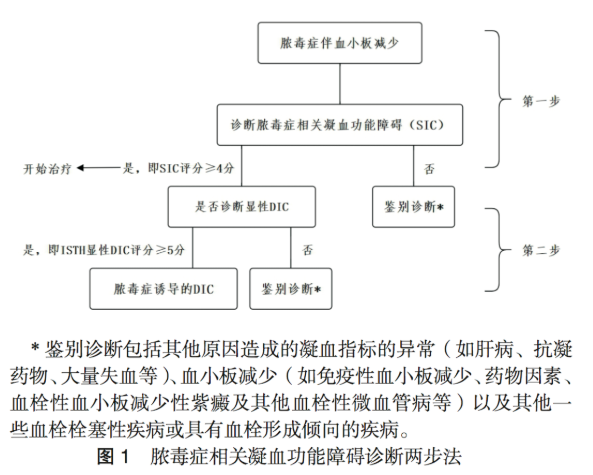
膿毒癥相關凝血功能障礙
(SIC) 指感染誘導的器官功能障礙和凝血功能障礙,診斷僅參考三個指標 :血小板、 PT- 國際正常化比值 (international
normalized ratio, INR) 和序貫器官衰竭評分( sequental organ failure
assessment,SOFA) 評分,評分 ≥ 4 分即可診斷 SIC(圖 1)。
四、急性出血性凝血功能障礙的治療
專家意見7 盡早消除或控制引起凝血功能障礙的病因。
4.1 病因治療
消除或控制潛在病因是治療急性凝血功能障礙的基礎。恰當地處理病因后,很多患者的凝血功能障礙能夠好轉。比如,對于膿毒癥誘發的凝血功能障礙,盡快使用敏感的抗生素和對感染灶引流是最重要的治療措施
;對于口服抗凝藥引起的出血,及時停藥或使用逆轉抗凝藥物可以糾正凝血功能障礙。
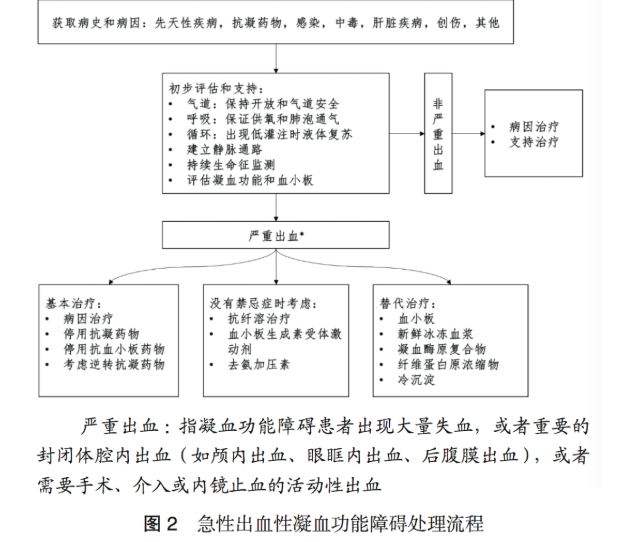
專家意見8 盡快完成病情嚴重程度的評估,同時給予足夠的生命支持。
4.2 初步評估和支持
存在急性凝血功能障礙時,需要快速完成氣道、呼吸和循環的評估,給予相應的初步支持 ;完成凝血功能指標的評估,特別是凝血因子消耗的相關指標和血小板計數,根據嚴重程度決定是否啟動替代治療 ;持續監測生命體征和出血表現,進行進一步治療 。
對于存在氣道梗阻和失去氣道保護能力的患者,需要及時開放氣道、進行氣管插管,防止誤吸和維持足夠的肺泡通氣。對于出血患者,需要進行氧療,提高氧飽和度,改善因血紅蛋白下降造成的氧供下降。對于有低灌注表現的患者,需要進行液體復蘇保持血流動力學穩定,并根據需要進行成分輸血。
4.3 嚴重出血的處理原則
存在急性出血性凝血功能障礙時,出血的嚴重程度決定了下一步治療方案的選擇。當凝血功能障礙患者無出血,或者只有輕微出血,且當前不準備實施侵入性操作時,不一定需要輸血和停止抗凝治療。當凝血功能障礙患者出現大量失血,或者重要的封閉體腔內出血 ( 如顱內出血、后腹膜出血、眼眶內出血等 ),或者需要手術、介入或內鏡止血的活動性出血時,這些情況被視為嚴重出血,存在致命性風險,需要積極干預。
干預措施包括 :停止使用抗凝或抗血小板藥物 ;當懷疑抗凝藥物造成嚴重出血時,考慮使用逆轉抗凝藥治療 ;在沒有禁忌證的情況下,考慮使用抗纖溶藥物 ;必要時使用替代治療。
4.4 藥物治療
專家意見 9 對于服用口服抗凝藥的出血患者,建議采用相關逆轉藥物治療。
4.4.1
直接口服抗凝藥的逆轉藥物 DOAC 的逆轉藥物用于 DOAC 抗凝伴隨嚴重出血的患者。特異性逆轉藥物包括艾達司珠單抗和 Andexanet
α。艾達司珠單抗用于特異性逆轉口服直接因子 IIa 抑制劑 ( 達比加群 )。2017 年REVERSE AD
研究證明艾達司珠單抗可逆轉達比加群的抗凝作用 ,艾達司珠單抗 5 g 給藥后 15 min
內,幾乎所有患者體內的抗凝效應均被完全逆轉,逆轉作用在大多數患者中維持了 24 h。
因此,艾達司珠單抗僅用于確信體內仍有大量達比加群的患者,不宜用于凝血酶時間
(thrombin time,TT) 正常的患者,僅在保守的出血控制措施無效且危及生命或需急診手術時使用該藥。Andexanet α
用于特異性逆轉因子Ⅹ a 抑制劑。它是因子Ⅹ a 的無催化活性形式,通過替代因子Ⅹ a 與因子Ⅹ a 抑制劑結合,保留因子 Xa 活性。2018
年美國 FDA 批準其用于利伐沙班或阿哌沙班引起的危及生命或不受控制的出血。
4.4.2 維生素 K
維生素K是合成Ⅱ、Ⅶ、Ⅸ和Ⅹ因子不可缺少的輔酶,谷氨酸殘基轉變為 γ - 羧基谷氨酸的過程中,需要維生素 K 依賴的γ -
谷氨酰羧化酶,因此這些凝血因子稱為維生素K依賴性促凝物。肝功能損害時,維生素 K 的攝入和腸道合成都可能存在問題,因此補充維生素K
是合理的。華法林是維生素 K 拮抗劑,其相關出血可用維生素 K 治療。
根據 2012 年美國胸科醫師學會 (ACCP) 和2018
年美國血液學協會 (ASH)的指南建議:INR > 10 但無出血,停用華法林,同時口服 2.5~5mg維生素K。每日或隔日監測
INR,必要時重復給予口服維生素 K。當 INR降至治療范圍時,以減低的維持劑量重新使用華法林。INR介于4.5~10
但無出血,停用華法林,同時給予或不給予小劑量口服維生素 K (1 ~ 2.5 mg)。INR < 4.5
且無出血,停用華法林或稍微減低維持劑量,密切監測 INR。
專家意見 10 對于存在纖溶亢進的出血患者,如果不存在 DIC,建議采用抗纖溶藥物治療。
4.4.3
抗纖溶 藥 物 氨 甲 環 酸 (tranexamic acid, TXA)和氨基己酸 (6-aminocaproic acid,
EACA)
是常用的抗纖溶藥物,能與纖溶酶和纖溶酶原上的纖維蛋白親和部位的賴氨酸結合位點吸附,阻止纖溶酶、纖溶酶原與纖維蛋白結合,從而抑制纖維蛋白分解。
TXA
和 EACA
可用于纖溶活性增加和低纖維蛋白原血癥的患者。比如肝衰竭和肝硬化時存在纖溶亢進,tPA發生上調,纖維蛋白溶酶原、抗纖溶酶和凝血酶激活的纖溶抑制劑發生下調
。研究表明上消化道出血患者使用 TXA 可以獲益 。需要指出,纖維蛋白沉積是 DIC
的重要特征,阻斷纖溶會增加血栓性并發癥的風險,所以抗纖溶藥物不推薦用于 DIC 治療。
專家意見11 對于存在骨髓抑制性血小板減少的出血患者,建議采用血小板生成素受體激動劑治療。
4.4.4
血小板生成素受體激動劑 血小板生成素受體激動劑 (thrombopoietin receptor agonist, TPO-RA)
通過刺激TPO受體而增加血小板計數,需要數日才能使血小板計數升高。通常使用 TPO-RA
的臨床情況包括慢性免疫性血小板減少癥、骨髓增生異常綜合征及化療誘發的血小板減少。由于該藥可能加重血栓栓塞性疾病,尤其是對有潛在易栓癥風險的患者,在選擇使用
TPO-RA 治療前需要謹慎評估出血和血栓形成的風險。
專家意見12 對于接受過抗血小板治療的出血患者,建議考慮去氨加壓素治療。
4.4.5
去氨加壓素可以釋放內皮血管性血友病因子 (von Willebrand factor, vWF) 和因子 Ⅷ,
增加血小板的黏附和聚集功能,既往用于治療血管性血友病和存在血小板遺傳缺陷的患者。研究發現去氨加壓素可以改善接受阿司匹林和氯吡格雷治療的患者的血小板功能
,對于接受過抗血小板治療的出血患者,可以使用去氨加壓素治療。
4.5 替代治療專家意見13 對于凝血功能障礙合并嚴重出血的患者,建議利用實驗室指標引導治療。
4.5.1
血小板 啟動輸注血小板的閾值取決于患者的臨床狀況
。對于出血、緊急侵入性操作和手術后患者,通常當血小板計數<50×10^9/L時,建議輸注血小板保持血小板計數 >
50×10^9/L。若有嚴重或中樞神經系統出血則保持血小板計數 > 100×10^9/L。當患者沒有明顯出血,除非血小板計數
<10~20×10^9/L,由于自發性出血風險增加應輸注血小板 。
需要指出,當擬診TTP時,應禁止輸注血小板,除非有嚴重危及生命的出血存在。當存在肝素誘導的血小板減少癥
(heparin-induced thrombocytopenia,HIT) 時,抗血小板因子4-
肝素復合物的自身抗體激活血小板可引起災難性動脈和靜脈血栓形成,應禁止輸注血小板。
4.5.2 新鮮冰凍血漿新鮮冰凍血漿
(fresh frozenplasma, FFP) 含有全部凝血因子和其他血漿蛋白。新鮮冰凍血漿和24h冰凍血漿 (plasma frozen
within 24 hours,PF24) 可用于 PT 或 APTT顯著延長( 超過 2 倍正常上限 ) 的出血患者的治療 。FFP
的起始劑量建議為15mL/kg。
對于肝臟疾病合并凝血障礙啟動血液成分治療的時機以及血漿成分的選擇,目前缺少證據且專家意見存在分歧 。一項面對肝病專家、血液病專家、重癥專家和外科專家的問卷調查顯示,對于 INR > 1.5 的患者是否在肝活檢前用 FFP,支持與反對的比例各占一半。對于肝移植前的凝血異常,有的專家選擇用 FFP 和血小板 ,有的選擇用凝血酶原復合物( prothrombin complex concentrate, PCC)和纖維蛋白原 。
由于缺少統一的意見,建議根據是否存在大出血風險來決定啟動血液成分治療的時機。對于DOAC引起的出血,由于缺少臨床證據支持冰凍血漿能夠有效逆轉DOAC,不建議使用
FFP 或 PF24來逆轉 DOAC 抗凝效果。對于INR>2 的華法林相關的嚴重出血,如果沒有PCC,可以使用 FFP(
起始劑量15~30mL/kg) 來逆轉華法林效應。
4.5.3 凝血酶原復合物凝血酶原復合物(PCC)包括活化凝血酶原復合物 (activated p rothrombin complexconcentrate, aPCC) 和未活化凝血酶原復合物 (3 因子PCC和4因子 PCC)。aPCC 是至少含有1種活化凝血因子的PCC。尚無高質量證據支持 aPCC 用于治療 DOAC 相關出血。但是,對于達比加群相關出血,如果沒有艾達司珠單抗,可以使用 Ⅷ 因 子 旁 路 活 性 抑 制 劑 (factor Ⅷ inhibitor-bypassing activity, FEIBA),起始劑量為 0 U/kg。
未活化PCC是從血漿中提純的凝血因子和抗凝物的濃縮物,含有高水平的凝血因子。3因子PCC含因子Ⅱ、Ⅸ和Ⅹ;4因子PCC含因子Ⅱ、Ⅸ、Ⅹ和Ⅶ。PCC可用于PT或APTT顯著延長(超過2倍正常上限)的出血患者的治療,特別是當容量負荷過重不適合用 FFP時。比如,對于 INR > 2 的華法林相關的嚴重出血,建議使用4因子PCC 來快速逆轉華法林效應。同時根據INR 決定劑量, INR > 6的患者一般用 50U/kg,在給予PCC 30 min 后復查 PT/INR。需要指出, PCC 缺乏部分重要凝血因子 ( 因子Ⅴ ),因此只能部分糾正凝血障礙。
4.5.4 纖維蛋白原濃縮物 當存在嚴重的低纖維蛋白原血癥
(<100mg/dL) 時,可以選擇纖維蛋白原或冷沉淀,使血漿纖維蛋白原水平增至>100
mg/dL。早期補充纖維蛋白原也是創傷性凝血病的關鍵治療。外源性纖維蛋白原來源包括 FFP、冷沉淀和纖維蛋白原濃縮物。由于 FFP
中的纖維蛋白原含量低,輸血相關并發癥的風險高,通常采用冷沉淀和纖維蛋白原濃縮物治療低纖維蛋白原血癥。4個單位FFP 和 2 袋冷沉淀
(15~20單位 ) 提供大致相當于3g 的純化纖維蛋白原 。
4.5.5 冷沉淀 冷沉淀由 FFP 在
4℃水浴箱中解凍后收集到的不溶性沉淀物制成,又稱冷沉淀抗血友病因子(antihemophilic factor,
AHF)。1U冷沉淀約為5~20 mL,包含了1U FFP中的大部分纖維蛋白原 (150 mg)、因子Ⅷ (80 IU)、因子ⅩⅢ (50 ~
75 IU)、血管性血友病因子(100~150 IU) 和纖連蛋白。對于低纖維蛋白原患者,1U冷沉淀可使血漿纖維蛋白原濃度增加至少7~10
mg/dL。若存在因子ⅩⅢ缺乏,則治療劑量約為1U/10 kg。
4.5.6 血源性或基因重組凝血因子對于遺傳性凝血因子缺乏患者,根據缺乏因子類型補充相應凝血因子,包括血源性和 ( 或 ) 重組凝血因子 ,比如,血友病 A 補充血源性凝血因子Ⅷ制劑或重組凝血因子Ⅷ制劑。對于獲得性凝血因子缺乏患者,可以補充旁路凝血因子 。人重組活化凝血因子Ⅶ是獲得性血友病的一線止血藥物,其推薦劑量為90μ g/kg, 每2~ 3 h靜脈注射1次,直至出血控制。
圖2 處理流程
總結
急性凝血功能障礙是一系列病因導致的凝血功能受損。通過臨床表現和實驗室檢查可以發現凝血功能障礙,而新型分子標志物有助于早期識別凝血功能障礙。不同病因的凝血功能障礙發病機制不同,消除病因是治療急性凝血功能障礙的基石。抗纖溶藥物、口服抗凝藥逆轉藥物和血液成分治療是常用的治療措施。但是,由于缺乏高質量的臨床證據支持,治療方案的制定需要動態評估病情和審慎權衡風險收益。