
長期以來,手性氨基酸都被認為對淀粉樣蛋白(Amyloid beta peptide, Aβ)結構和功能有調控作用。然而,這背后的分子機制并不是十分清晰。2019年11月6日,美國威斯康星大學麥迪遜分校李靈軍課題組(第一作者李功玉)在Nature Communications雜志上發表了一篇題為“Molecular Basis for Chirality-regulated Aβ Self-assembly and Receptor Recognition Revealed by Ion Mobility-Mass Spectrometry”的文章,通過新型離子遷移質譜揭示了氨基酸手性對Aβ結構的影響。

該文通過開發一整套基于新型離子遷移質譜的快速手性分離分析平臺(作者將該方法命名為integrative chirality anatomy platform, iCAP),覆蓋了Aβ單體,多聚物和受體結合復合物的氨基酸手性效應,重點克服了傳統離子遷移質譜在結構分辨率上的不足,實現不改儀器硬件的前提下提高超過十倍結構分辨率,成功從手性混合物中分辨出單個氨基酸手性突變的Aβ立體異構體,并揭示了不同氨基酸手性突變對其聚集傾向和受體結合的差異性影響,重點關注自然界常見手性突變的天冬氨酸(Asp)和絲氨酸(Ser)。該研究揭示了在未來針對老年癡呆癥的藥物開發時,手性突變的Aβ異構體也應該作為靶向研究不可忽略的一個方面,畢竟氨基酸的手性影響著Aβ的各方面物理化學性質。
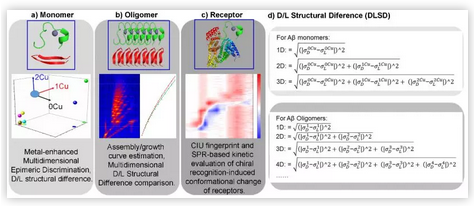
圖1. 快速手性分離分析平臺流程示意圖。
圖1顯示的是快速分離分析平臺的“三步驟”工作流程示意圖。第一步,針對手性突變的Aβ單體,作者提出用“金屬離子放大法”,即通過多肽-金屬離子相互作用依賴于多肽本身結構的這個屬性,將多肽結構的差異和多肽-金屬復合物的結構差異結合起來分析(圖1a),以此來放大Aβ個別氨基酸手性突變引起的單體結構差異性。第二步,通過繪制Aβ寡聚物生長曲線的方式(圖1b),從分子量水平上可視化Aβ的聚集過程。進一步計算每一個寡聚物的結構差異,并提出一種全新的手性放大計算法(圖1d),從而實現從結構變化的角度定量表征Aβ聚集過程中的手性效應。第三步(圖1c),作者使用了近年來比較流行的蛋白質氣相結構分析工具,“碰撞誘導解折疊”(collision-induced unfolding, CIU),結合溶液相動力學手段,系統表征了氨基酸手性在Aβ-受體相互作用過程中的影響。值得一提的是,作者本文所采用的是Aβ片段(包括N-端和C-端),這樣就可以在不受干擾的前提下,針對性研究手性對不同結構域的結構影響程度。
多肽-金屬離子的結合是被廣泛認可的會調節淀粉樣蛋白聚集的幾個重要因素之一。本文作者創造性地利用金屬離子結合依賴于多肽本身結構的特點,基于手性突變的多肽在結構上會有一些差異,因此金屬離子結合以后的復合物在結構上應該也會有所不同。如何將多肽本身的結構差異和金屬離子結合的多肽復合物的結構差異統一起來,以此實現手性差異放大,成為本文工作的一大亮點。作者對Aβ單體和其他神經肽進行了手性分析。在收集到apo-多肽、結合一個Cu的多肽復合物和結合兩個Cu的多肽復合物的結構信息之后(CCS,collisional cross-section, 碰撞截面),作者依次將相關結果呈現在一維、二維和三維的坐標軸上。當只考慮apo-多肽的結構信息時,手性分離的效果很差,很多情況下幾乎無法分開。這是由于這些多肽大都只有一個或少數幾個氨基酸位點發生手性突變,因此結構改變也很小,一般的商業化的離子遷移質譜無法將其分開。有趣的是,在二維分離坐標中,作者發現原來擁擠在一塊的D-和L-神經肽被有效地拉開了,這是由于引入了一個Cu-結合的多肽復合物結構信息,手性效應由此被放大。這種手性放大效應可以通過引入第三個坐標,結合兩個Cu-的多肽復合物的結構信息,進一步被放大。
老年癡呆癥的一個典型特征是大腦中細胞周圍的淀粉樣斑塊沉積。一直以來,這種淀粉樣斑塊都被認為與老年癡呆發病機制密切相關,雖然目前的機理尚不明確。因此,作者也針對性地開發了相關策略用于研究氨基酸手性突變對Aβ 聚集過程的影響。他們將該平臺應用于Aβ 聚集過程中的氨基酸手性效應研究。他們發現各種條件下的手性突變并不會大幅度改變生長方式,即單個氨基酸手性突變不會顯著影響整條Aβ 聚集路徑。有趣的是,作者發現,雙氨基酸(Asp和Ser)共同突變會顯著降低最高的聚合度。作者進一步利用多維手性放大計算法,結合該快速手性分離分析平臺,數據表明,手性突變對Aβ 聚合物的結構改變程度遵循以下順序:雙氨基酸(Asp和Ser)共同突變 > 單點Asp突變 > 單點Ser突變。這一點上看,手性效應在Aβ單體和寡聚物的結構方面的影響是一致的。值得一提的是,這種手性效應在混合野生型和突變型Aβ之后變得更加明顯,而這可能是更接近實際生物體系的情況,因為在實際條件下,兩者在很大概率情況下會共存。
然而,蛋白或者多肽一般不會獨自起作用。相反,絕大部分條件下,這些蛋白或多肽需要與周圍環境中的多種結合受體發生各種動態的相互作用,以發揮他們的有效功能。因此作者最后還考察了氨基酸手性突變對其受體結合能力的影響。為了實現這一目標,作者首先訴諸于快速的氣相結構分析手段,CIU-IM-MS,即碰撞誘導去折疊離子遷移質譜的方法(Collision-induced Unfolding-Ion Mobility-Mass Spectrometry)。該技術手段可以在消耗很少樣品的前提下,快速有效靈敏地揭示蛋白質在氣相中的局部微小的蛋白質結構轉變。其次作者還進一步使用了溶液相動力學手段SPR,即surface plasmon resonance ,表面等離子共振技術,檢測了手性突變對受體結合的動力學差異。作者總結D-型突變顯著降低了受體結合的親和力以及對應的結合速率。總的來說,C端Aβ片段和TTR(transthyretin, 甲狀腺素轉運蛋白)的結合都在微摩爾級別,相對比較弱。而作者進一步對N端Aβ片段和HSA(human serum albumin, 人血清白蛋白)的結合進行了手性分析。結果顯示,手性突變對N端Aβ-HSA 結合具有破壞性的作用而且其程度遵循以下順序:雙氨基酸(Asp和Ser)共同突變 > 單點Asp突變 > 單點Ser突變。綜合起來看會發現,手性效應在Aβ單體、寡聚物結構以及N端Aβ-HSA 結合方面的影響是一致的。然而,手性突變對C端Aβ-TTR 結合具有破壞性的作用卻遵循以下順序:單點Asp突變 > 單點Ser突變 > 雙氨基酸(Asp和Ser)共同突變。作者認為這些結構域依賴性的手性效應應該跟Aβ本身的結構特點相關,因為它本身的N端和C端具有截然不同的晶體結構。進一步對該假說進行驗證以及在完整序列的Aβ上研究手性突變的影響會使本文的發現更有實際意義。
主要作者介紹:
? 李靈軍,通訊作者,美國威斯康星大學麥迪遜分校藥學院教授,2000年于美國伊利諾伊大學香檳分校獲得化學博士學位, 之后在美國太平洋西北國家實驗室和布蘭迪斯大學進行博士后研究。2002年起在美國威斯康星大學麥迪遜分校任教。現任威斯康星大學麥迪遜分校藥學院和化學系雙聘教授,獲威斯康星大學Charles Melbourne Johnson藥物科學與化學杰出講座教授和Vilas 杰出成就教授稱號。李靈軍教授長期致力于生物分析科學以及質譜相關技術的研究, 主要涉及的領域有神經肽組學、蛋白質組學、代謝組學等, 并應用這些尖端的分析方法和技術解決神經生物學、基礎和臨床醫學中的關鍵性問題。
? 李靈軍課題組(已畢業47位博士生,21位在讀博士生,6位博士后)在生物分析化學領域的貢獻主要在構建基于高靈敏度質譜多維分析平臺, 并將此平臺應用于新型神經肽組學研究, 在高水平雜志上發表論文280多篇, 受邀學術報告200余場。李教授先后被授予分析化學個人成就獎(匹茲堡會議)、美國國家科學基金委生涯獎、美國質譜學會研究獎、斯隆基金會研究獎, 以及2014 年Biemann Medal。2016年入選全球50位最有影響力女分析化學家。2019年 入選分析科學家Top 100 Power List (全球100位最有影響力的分析科學家)。李靈軍教授現任美國質譜學會(JASMS)副主編和分析與生物分析化學(Analytical and Bioanalytical Chemistry)編委會成員。
? 李功玉,第一作者,現為美國威斯康星大學麥迪遜分校李靈軍教授課題組博士后,曾在中科大黃光明教授課題組攻讀博士學位期間(2012年 -2017年)開始接受質譜的系統訓練,并在2016年和2019年先后兩次訪問美國密歇根大學Brandon Ruotolo教授實驗室學習離子遷移質譜。自2017年8月加入李靈軍課題組以來,李博士的主要研究興趣包括開發基于離子遷移質譜和敞開式大氣壓質譜的原位蛋白質質譜新方法,用于解決人類疾病相關蛋白質在復雜體系中的直接鑒定和快速結構分析的技術難題及相關拓展應用。李博士的相關工作已以其為第一作者身份發表了包括2篇Nature Communications(其中一篇被該雜志編輯入選為Featured Editors Highlights文章),3篇Analytical Chemistry和1篇Trends in Analytical Chemistry等在內的多篇業內高水平研究論文。鑒于其在原位蛋白質質譜領域的創新性研究成果,李博士于2019年被美國質譜學會授予該年度博士后職業發展獎(2019 ASMS Postdoctoral Career Development Award)以及入圍2019年度美國光譜分析化學學會年度創新獎(2019 Federation of Analytical Chemistry and Spectroscopy Societies Innovation Award)。
原文鏈接:
https://www.nature.com/articles/s41467-019-12346-8
近年來隨著離子淌度技術和質譜技術的發展,離子淌度質譜越來越受到用戶的關注,在化合結構表征、復雜化合物分析等都有其特有的優勢,迅速成為前沿科學工作者的“心頭愛”。......
分析測試百科網訊2019年10月24日,由分析測試百科網主辦的2019年ANTalk分析測試百家講壇暨ANTOP頒獎盛典于國家會議中心隆重召開。經專家和網友的評審、投票,沃特世的SELECTSERIE......
分析測試百科網訊2019年10月24日,由分析測試百科網主辦的2019年ANTalk分析測試百家講壇暨ANTOP頒獎盛典于國家會議中心隆重召開。沃特世BioAccordLC-MS系統和SELECTSE......
通過集中合作開發的SELECT系列CyclicIMS將新型環形離子遷移率分離技術與最先進的高性能飛行時間質譜技術結合起來,使領先的研究人員能夠重新定義科學的界限。1.推動離子遷移率分離的邊界2.提供可......
分析測試百科網訊日前,阿斯頓大學和沃特世公司(NYSE:WAT)宣布在該大學健康與生命科學學院內安裝了世界上第一臺Waters?SELECT系列?Cyclic?IMS(環形離子遷移質譜儀)質譜儀,該儀......
長期以來,手性氨基酸都被認為對淀粉樣蛋白(Amyloidbetapeptide,Aβ)結構和功能有調控作用。然而,這背后的分子機制并不是十分清晰。2019年11月6日,美國威斯康星大學麥迪遜分校李靈軍......
長期以來,手性氨基酸都被認為對淀粉樣蛋白(Amyloidbetapeptide,Aβ)結構和功能有調控作用。然而,這背后的分子機制并不是十分清晰。2019年11月6日,美國威斯康星大學麥迪遜分校李靈軍......
長期以來,手性氨基酸都被認為對淀粉樣蛋白(Amyloidbetapeptide,Aβ)結構和功能有調控作用。然而,這背后的分子機制并不是十分清晰。2019年11月6日,美國威斯康星大學麥迪遜分校李靈軍......
開發具有快速、原位特點鑒定并表征蛋白結構的技術是基于質譜的蛋白組學研究面臨的迫切需求,但是在狹窄空間中很難同時完成多種任務。在2019年10月16日,發表在NatureCommunications上的......
灑下的汗水是青春,埋下的種子叫理想。守在悉心耕耘的“大地”,用創新留下豐碑,靜待收獲的時節。2019ANTOP獎正方興未艾,多家科學儀器企業競相參與申報,這里將為您介紹ANTOP獎項“打榜”產品。沃特......