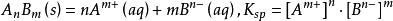在一定溫度下,難溶電解質晶體與溶解在溶液中的離子之間存在沉淀溶解和生成的平衡,稱為沉淀溶解平衡。
將難溶電解質AgCI放入水中,固體表面的一部分Ag和Cl在水分子的不斷作用下脫離AgCl固體,與水分子締合成水合離子進入溶液,此過程稱作沉淀的溶解;與此同時,溶液中的水合Ag+和Cl-不斷運動,其中一部分受到AgCl固體的表面帶相反電荷的離子吸引,又會重新結合成固體AgCI,此過程稱作沉淀的生成。難溶電解質的溶解和生成是可逆過程。
一段時間后,當難溶電解質溶解的速率和生成的速率相等,溶液中各離子的濃度不再發生變化,難溶電解質固體和溶液中水合離子間的沉淀溶解平衡由此建立:AgCI(s)≒Ag+(aq)+Cl-(aq)
該反應的平衡常數表達式如下: