免疫療法方興未艾,并在腫瘤治療中展現出極佳的治療效果,而抗腫瘤T細胞療法是免疫療法的重要代表。
細胞毒性CD8 T細胞可以直接殺死腫瘤細胞,是在臨床使用的許多免疫治療方法中動員的關鍵武器。然而,腫瘤組織能夠創造嚴酷的微環境,招募免疫調節細胞,并誘導抑制T細胞功能的信號分子的產生,從而阻礙了T細胞的功能、聚集和腫瘤浸潤。
這些研究表明抗腫瘤T細胞療法的療效會因為腫瘤組織的抵抗性反應而逐漸衰弱,那么,我們該如何去規避這一現象的發生呢?
2019年12月11日,美國田納西州孟菲斯圣猶達兒童研究醫院遲洪波團隊在 Nature 雜志上發表了題為:Targeting REGNASE-1 programs long-lived effector T cells for cancer therapy(以REGNASE-1為靶點的重編程長壽命效應T細胞用于癌癥治療)的研究論文。
論文研究發現,REGNASE-1蛋白的缺失延長了抗腫瘤CD8 T細胞的存活,增強了它們的功能,使T細胞能夠更好地、更有效地與癌癥作斗爭。
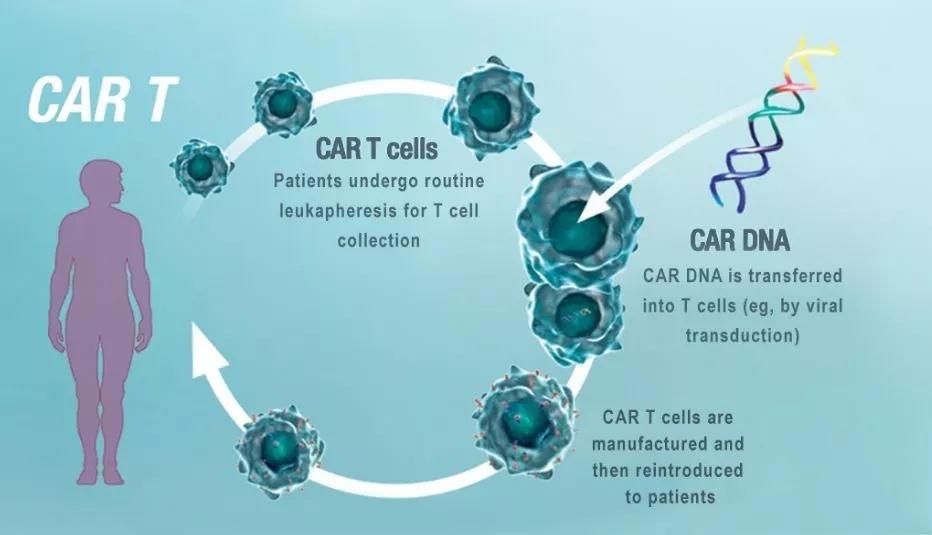
免疫細胞抗腫瘤療法深刻地改善了對某些惡性腫瘤的治療,最常見的便是過繼性T細胞治療(ACT)。這種方法依賴于從人的血液或腫瘤中取出的T細胞,在實驗室進行刺激以誘導分裂分化甚至修改細胞表面受體,使其轉化為抗腫瘤T細胞,再回輸到病人體內,從而殺傷患者體內的腫瘤細胞。例如,CAR-T療法,在T細胞上表達一種專門針對腫瘤細胞的受體——嵌合抗原受體(CAR-T),這一療法在治療白血病等血液腫瘤上是非常成功的。
盡管免疫細胞療法具有巨大的潛力,但目前ACT的治療效用是有限的,因為回輸到患者體內的改良T細胞往往僅能短暫存在,而且常常無法克服腫瘤組織的抵抗性作用。正常情況下,機體內抵抗了病原體或腫瘤細胞后,會留下一類被稱為記憶T細胞長壽命細胞,它們是自我更新的,如果再次遇到相同的感染或惡性腫瘤,它們可以迅速增殖產生大量的細胞毒性CD8 T細胞。然而,如果不能消除感染或腫瘤,細胞毒性T細胞將逐漸失去其功能(稱為exhaustion的過程)。
用于ACT的理想T細胞群能夠浸潤腫瘤并大量積累,同時保留細胞毒性功能和自我更新能力。但T細胞分化為細胞毒性CD8T細胞損害了成功保留了形成長期記憶細胞的潛力。研究者于是提出了這樣一個問題:是否有一種策略可以在ACT的T細胞中誘導出這兩種有益的性狀。
研究表明,在復雜的腫瘤微環境中,CD8 T細胞需要有強烈的新陳代謝,以維持生存所需的營養和能量需求,從而保持其抗腫瘤活性。
于是該團隊等利用CRISPR/Cas9文庫篩選技術敲除了3000多個與T細胞代謝相關的基因,在小鼠抗腫瘤ACT模型中對這些基因的功能進行了檢測。研究團隊鑒定了200多個基因,這些基因可以顯著影響轉移到荷瘤小鼠體內的CD8 T細胞的持久性和功能。許多基因的破壞會對細胞的存活能力產生負面影響,從而在腫瘤中積累,但有4個基因的破壞會導致更多的T細胞浸潤腫瘤組織。
這4個基因中作用最顯著的是編碼REGNASE-1酶的基因,該酶與RNA結合并降解RNA,從而影響免疫應答,但其在CD8 T細胞抗腫瘤作用中的作用尚未見報道。REGNASE-1缺失的CD8 T細胞在腫瘤組織中的積累量是正常CD8 T細胞的2000倍。缺乏REGNASE-1的CD8 T細胞比野生型CD8 T細胞能更好地對抗兩種腫瘤——黑色素瘤和急性淋巴細胞白血病。
為了更好地理解REGNASE-1缺失導致T細胞在腫瘤組織中持續性增加的原因,作者分析了REGNASE-1缺陷型細胞和野生型細胞的基因表達譜。REGNASE-1的缺失與記憶T細胞分子特征的增加有關,表明存在比正常群體更大的長壽命記憶樣細胞,這些細胞可快速增殖產生細胞毒性CD8 T細胞。
Regase-1缺失的CD8T細胞表現為線粒體功能顯著增加(線粒體是提供細胞能量的關鍵來源的細胞器),包括產生能量和消耗氧氣的能力。這是十分值得注意的,因為這種能力在抗腫瘤T細胞中經常受到損害。
REGNASE-1缺陷的這些聯合效應若能應用于ACT的CD8 T細胞和CAR-T細胞,那么便能使ACT免疫療法產生質的飛躍——重編程T細胞在靶向的癌癥中積累并隨時間保持活性。
為了進一步了解這一機制,研究團隊使用CRISPR/Cas9敲除文庫來破壞REGNASE-1缺陷的CD8 T細胞中的大約20000個基因,以查明介導REGNASE-1依賴性細胞重編程的關鍵下游基因。
轉錄因子BATF是CD8 T細胞分化的關鍵調控因子,它的失活使缺乏REGNASE-1的T細胞的長壽命和與線粒體相關的高表達基因不復存在。作者發現,REGNASE-1與PTPN2或SOCS1兩種蛋白的聯合缺失具有協同效應,與僅缺失REGNASE-1的T細胞的特性相比,更能增加T細胞的持久性、積累量和抗腫瘤活性。
研究團隊報道了REGNASE-1缺失的腫瘤記憶樣細胞和細胞毒性CD8 T細胞中,其細胞毒性蛋白的表達均高于野生型CD8 T細胞。具有記憶性質的野生型細胞一般不會直接殺死腫瘤細胞,而REGNASE-1缺失記憶樣T細胞是否僅具有自我更新和增殖產生細胞毒性CD8-T細胞群的功能,或是否也能直接介導腫瘤細胞殺傷尚不清楚。
如果REGNASE-1缺失的記憶樣T細胞擁有殺傷腫瘤細胞的能力,那么它又是如何保持自身活性的呢?更有趣的是,研究者表示,REGNASE-1缺失的CD8 T細胞需要遇到特異性識別的腫瘤抗原才能持續保持活性。這可能解釋了為什么抗腫瘤T細胞相比于富含T細胞難以接觸到腫瘤抗原的脾臟組織,更顯著地在小鼠腫瘤組織中的聚集。
腫瘤微環境中的其他因素是否有助于增強REGNASE-1缺失CD8 T細胞的持久性仍有待研究。為此,對REGNASE-1、PTPN2、SOCS1和BATF組合性缺失的CD8 T細胞的代謝特征進行評估可能具有極好的參考價值。
這將有助于我們了解這些蛋白對CD8T細胞代謝重編程的影響,以及這對細胞分化和抗腫瘤功能的重要性。此外,在這種情況下找到相關的代謝物可能會為這些CD8 T細胞如何受到營養缺失的腫瘤微環境的影響提供線索。
這項研究為ACT免疫療法的發展提供了重要的理論依據。十分值得去嘗試在CAR-T細胞的制造過程中,利用CD8 T細胞來刪除或表達低水平的REGNASE-1基因,并觀察其可行性。
最后,鑒于腫瘤細胞中PTPN2的抑制使其對免疫治療更具敏感性,那么我們是否可以在ACT免疫療法中以REGNASE-1 CD8 T細胞和PTPN2抑制劑進行聯合治療,從而使腫瘤免疫治療的療效更強大、更持久。
近日,記者從北京協和醫院獲悉,該院肝臟外科副主任(主持工作)杜順達教授團隊為一名乙肝相關肝癌的晚期患者進行了特異性T細胞免疫治療并長期隨訪觀察。據悉,這是全球首例乙肝特異性T細胞療法在晚期肝癌患者中的......
近日,《美國化學會·納米》在線發表中國科學院院士、國家納米科學中心研究員陳春英課題組在抗腫瘤納米藥物研究領域的最新成果。該團隊首次在乏氧腫瘤細胞表面形成納米纖維狀水凝膠結構,抑制腫瘤外泌體擴散,同時攜......
“做老百姓吃得起的好藥,讓中國原創新藥早日走向世界。”在上海市浦東新區張江科學城內,有一處被譽為“張江藥谷”的地方。這里匯集了包括中國科學院上海藥物研究所(以下簡稱上海藥物所)在內的一批藥物研發中心,......
氨被認為是一種細胞毒素,它在血液中的增加會損害細胞功能。然而,這種毒素是否以及如何在病理生理條件下引發細胞死亡仍不清楚。2024年9月11日,華中科技大學黃波團隊在NatureCellBiology(......
9月11日,《自然-細胞生物學》發表了華中科技大學黃波教授團隊有關T細胞死亡的研究成果。研究發現,CD8+T細胞激活的過程中細胞內氨逐漸積累最終導致T細胞死亡。據悉,這一獨特死亡方式的分子機制,為異己......
8月28日,上海市藥監局發布了《上海市自體嵌合抗原受體T細胞(CAR-T)治療藥品監督管理規定》以及這一監管規定的政策解讀通知,本規定自2024年9月1日起施行,有效期5年,有效期至2029年8月31......
近日,一篇發表在國際雜志MolecularTherapy—Methods&ClinicalDevelopment上題為“MetabolicprimingofGD2TRAC-CARTcellsd......
近日,由華東師范大學上海分子治療與新藥創制工程技術研究中心教授章雄文團隊與復旦大學科研團隊共同研發的在抗腫瘤惡病質與增肌領域的臨床前小分子原創新藥,與國際生物制藥公司達成了總額為1億美元全球權益合作。......
抗腫瘤藥物千千萬,實際能走到臨床、甚至上市的卻寥寥無幾。是什么阻礙了抗癌藥物的開發進展?帶著這一疑問,我們走進了長春應化所,拜訪了湯朝暉教授團隊的助理研究員徐亞軍老師。湯朝暉教授團隊專注于聚氨基酸為介......
近日,國家藥品監督管理局(NMPA)批準了高選擇性JAK1抑制劑戈利昔替尼上市申請,用于治療復發難治性外周T細胞淋巴瘤(r/rPTCL)。外周T細胞淋巴瘤是一種起源于胸腺后成熟T/NK細胞的惡性腫瘤,......