抗體是由B細胞轉化而來的漿細胞分泌的,每個B細胞株只能產生一種它專有的、針對一種特異性抗原決定簇的抗體。這種從一株單一細胞系產生的抗體就叫單克隆抗體(McAb),簡稱單抗。第一代單抗來自于Koehler和Milstein于1975年開發出的雜交瘤(hybridoma)抗體技術:在細胞融合技術的基礎上,將能夠分泌特異性抗體的小鼠致敏B細胞和具有無限繁殖能力的小鼠骨髓瘤細胞融合為B細胞雜交瘤,用具備這種特性的單個雜交瘤細胞培養成細胞群,可制備針對一種抗原表位的特異性抗體,即單克隆抗體(monoclonal antibody,Mab),簡稱單抗,如圖1所示。但是,人體免疫系統能夠識別鼠源性單抗,會引起人抗鼠抗體反應(HAMA),這不僅讓治療性單抗藥物半衰期變短,療效減弱,有時還會引起嚴重的不良反應,因此第一代單抗的臨床應用受到了很大限制。
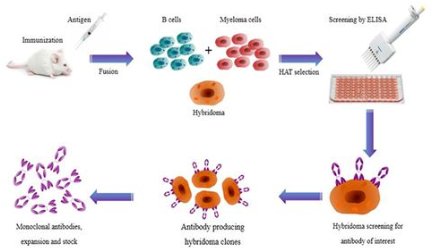
圖1.雜交瘤抗體技術示意圖,圖片來自Frontiers in Microbiology, 2017, doi:10.3389/fmicb.2017.00495。
自從1986年全球第一個鼠源性單抗藥物Muromonab OKT3問世,全球已近有80個單抗藥物上市。迄今為止,單抗藥物已經發展到了第四代:第一代為鼠源單抗(momab),第二代為人鼠嵌合型單抗(ximab),第三代為人源化單抗(zumab),第四代為全人源化單抗(mumab)。人源化單抗和全人源化單抗的優勢在于可以克服人抗鼠抗體反應,可避免單抗分子被免疫系統當作異源蛋白而被快速清除,提高單抗分子的生物學活性。特別地,全人源化單抗的可變區和恒定區都是人源的,可在人源化單抗的基礎上進一步去除免疫原性和毒副作用。人源化單抗藥物和全人源化單抗藥物具有高親和力、高特異性以及毒副作用小的特點,極大地克服了鼠源單抗和人鼠嵌合型單抗藥物的各種缺點,因而已經成為了治療性抗體藥物發展的必然趨勢。
單抗藥物作用的靶點通常為細胞表面的疾病相關抗原或特定的受體,比如位于腫瘤細胞表面上的受體PD-1和位于T細胞表面上的配體PD-L1。在單抗藥物中,風頭正勁的PD-1/PD-L1抑制劑就屬于單抗藥物,是近年來腫瘤免疫療法研究的熱點。已上市的納武單抗和派姆單抗屬于PD-1抑制劑,主要用于黑素瘤和非小細胞肺癌的治療,對腎細胞癌、膀胱癌、霍奇金淋巴瘤等的療效還在大規模臨床試驗中。PD-L1抑制劑阿替珠單抗(atezolizumab,商品為Tecentriq)、度伐單抗(durvalumab,商品名為Imfinzi)和阿維單抗(avelumab,商品名Bavencio)已被批準用于治療尿道上皮癌,還有其他幾種藥物尚處于早期臨床試驗階段。2018年9月28日,FDA批準了由賽諾菲(Sanofi)和再生元(Regeneron)聯合研發的Libtayo(cemiplimab-rwlc)上市,用于治療轉移性皮膚鱗狀細胞癌(CSCC)或不能接受治愈性手術或放療的局部晚期CSCC患者。這也是由FDA批準獲批上市的第3款抗PD-1抗體。
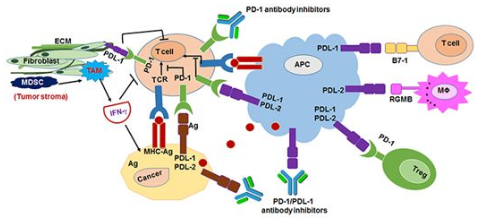
圖2.PD-1/PD-L1抑制劑作用機制,圖片來自Frontiers in Pharmacology,2017, doi:10.3389/fphar.2017.00561。
截至目前,單抗藥物已經成為生物醫藥的重要組成部分,在醫藥治療上也具有廣闊的應用前景,已經被成功用于治療腫瘤、自身免疫性疾病、感染性疾病和移植排斥反應等多種疾病。但是,在制備單抗藥物技術中面臨著不少瓶頸。當前,抗體藥物研發的瓶頸在于靶分子的篩選,抗體人源化和人抗體制備,抗體的高通量大規模篩選技術,抗原表位的預測、建模和分析技術,抗原-抗體相互作用的立體構型構建和各種增加抗體效應功能的技術等。
1.抗體藥物靶標篩選
傳統抗體藥物研發的方法是在單個基因、單個蛋白及單個抗體水平上研發,首先需要經過許多年的時間研究這個基因和及其編碼蛋白的功能,確認是否能夠將這個基因及其編碼蛋白作為抗體藥物靶標來研發抗體藥物。這種方法的缺點主要在于:所獲得的抗體藥物靶標的數量極其有限,并且這些靶標都是十多年前就已發現的;歷時長,一般需要十到二十年的時間。隨著基因組學、轉錄組學、蛋白質組學和測序技術研究不斷取得進展,人們發現的新基因和新蛋白的數量越來越多,從而有望從中挑選出合適的抗體藥物靶標。
抗體藥物靶標篩選的標準是什么呢?以抗腫瘤彈藥藥物靶標為例,首先靶標表達要有差異,比如在正常組織和腫瘤組織要有差異,或者在關鍵宿主器官中表達缺失,或者在疾病進展中一直表達。其次,靶標要起到作用,當使用抗體進行治療時,抗原不能輕易地酶降解掉。從已知治療靶標產生高親和力的抗體不是主要障礙,主要挑戰是篩選靶分子。
如今,科學家們已采用人抗體技術和全人抗體技術,希望通過人體免疫系統找到一些更好的抗體靶標,從而開發出療效更好的抗體藥物。全人抗體技術是通過人-鼠雜交瘤技術、人-人雜交瘤技術、B細胞永生化和我們在這些技術上通過改進產生的高效高通量全人抗體庫技術,抗體的選擇、成熟和產生都是在人體中形成的,因而是嚴格意義上的全人抗體。抗體靶標的確定、抗體的產生和轉錄后修飾都是由人體的免疫系統經過一系列篩選后完成,這種技術產生的抗體具有天然的最佳親和力和結合力,并且更有效地作用于人體。高效高通量全人抗體庫技術將能夠分泌抗體的目的細胞分離、純化、富集和增殖。B細胞亞克隆后所分泌的抗體的特異性可通過ELISPOT、ELISA或溶血空斑試驗進行篩選和鑒定。從單克隆培養的細胞株中獲取目的抗體的基因序列,構建原核或真核表達載體,轉入工程菌或細胞進行表達,就可重建抗體的活性。
2.單抗藥物的免疫原性分析
目前已在臨床使用的單抗藥物常見的不良反應主要是由它們的免疫原性引起的。免疫原性引起的抗藥物抗體對藥物的安全性和有效性有很大影響。免疫原性的強弱是生物技術藥物開發的決定因素之一,因此在評價藥物安全性時,需同時考慮它們的免疫原性。為此,科學家們分別采取抗體人源化、改善溶解特性、蛋白修飾(比如蛋白聚乙二醇化修飾)和改善效應分子功能(可通過構建隨意突變CDR或整個可變區結構域的高通量文庫,然后從中篩選高親和力變異體,或者模擬體內親和力成熟的顯著突變或熱點突變基因構建小容量文庫)等措施來改善單抗藥物的免疫原性。
抗體聚乙二醇化修飾,圖片來自Scientific Reports, 2017, doi:10.1038/s41598-017-15051-y。
當前評價和分析單抗藥物免疫原性的方法為酶聯免疫分析法、液相-質譜聯用、表面等離子共振法、電化學發光法和放射免疫分析法等。但是,這些方法存在免疫原性臨界值的判斷尚無統一定論,而且免疫原性的臨界值因分布規律、計算公司等不同而存在差異,這就使得不同藥物間的接受標準無法統一。不過,隨著分子生物學技術的不斷取得進展,提高單抗藥物的人源化成分,甚至達到全人源抗體,改善它們的結合和效應分子功能,再結合蛋白修飾,有望避免單抗藥物的免疫原性。與此同時,完善免疫原性檢測方法,讓它統一化、標準化,使得臨床試驗具有明確的指導原則,最終加快單抗藥物的臨床應用。
3.高通量的動物細胞表達技術
從蛋白表達體系而言,近年來,科學家們不足開發和優化了很多抗體分子的表達體系,比如,細菌、酵母、昆蟲細胞、哺乳動物細胞、植物細胞表達系統和體外表達系統等。其中,哺乳動物細胞表達系統具有活性高、穩定性好等重要優點,已成為抗體生物技術產品制造的最為重要的表達體系。
從抗體制備規模、速度和功能來看,高通量抗體制備技術的發展十分重要。哺乳動物細胞表達生物技術產品大規模高效培養技術是生物醫藥產品的主要生產方式和關鍵瓶頸技術。目前國際上這方面的技術有流加培養技術和灌流培養技術。
4.人源化抗體和全人源化抗體構建和優化技術
隨著免疫學和分子生物學技術的不斷發展,DNA重組技術越來越多地用于抗體構建和優化。針對人源化抗體的構建和優化技術有表面重塑抗體(resurfacing antibody)和重構抗體(reshaped antibody)。表面重塑抗體是指對異源抗體表面氨基酸殘基進行人源化改造。該方法的原則是僅替換與人抗體表面可及殘基(SAR)差別明顯的區域,在維持抗體活性并兼顧減少異源性基礎上選用與人抗體表面殘基相似的氨基酸替換;另外,所替換的區段不應過多,對于影響側鏈大小、電荷、疏水性,或可能形成氫鍵從而影響到抗體互補決定區(CDR)構象的殘基盡量不替換。重構抗體指由異源抗體中與抗原結合相關的殘基與人抗體重新剪接構建的抗體,包括互補決定區移植、部分補決定區移植和特定決定區轉移。
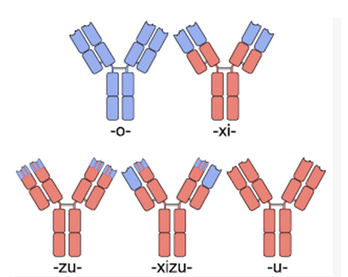
嵌合抗體和人源化抗體,圖片來自Wikipedia。
全人源化抗體的輕鏈和重鏈都來源于人,是治療性抗體的發展區域。目前針對全人源化抗體的構建和優化技術有抗體庫篩選技術,如鏈置換、基因工程小鼠制備全人源化抗體。比較成熟的抗體庫篩選技術有:噬菌體抗體庫、合成抗體庫和核糖體展示技術。
抗體組技術是在基因組學和蛋白組學基礎上,結合雜交瘤技術及基因工程抗體技術,經過抗體靶標高通量篩選、建立大規模抗體庫,最終走向應用。相比傳統的單克隆抗體技術相比,抗體庫技術,具有庫容量大、可篩選種類多、更易獲得針對特定抗原表位的高活性單克隆抗體等無以替代的優勢。同時抗體庫技術在篩選過程中,更為省時、省力、高效、經濟。
小鼠目前依然是最容易進行免疫和其后續進行基因工程操作的動物品種,然而通過小鼠抗體庫獲得的依然是鼠抗體V區基因,想使其安全用于臨床,還必須進行后續的人源化改造。近兩年發展的全人抗體的轉基因小鼠技術,使得我們可以通過轉有全套人抗體基因的轉基因小鼠來制備人的免疫抗體庫,并從中直接篩選具有治療價值全人的抗體V區基因,無需人源化的改造。
5.新型抗體藥物開發
傳統抗體藥物通過封閉單一信號通路抑制腫瘤生長,臨床上易出現抗體藥物的耐藥性。所以雙特異性抗體(BsAb)應運而生,其通過基因工程手段將兩個分別靶向不同抗原的抗體片段組合在一起,具有兩種抗原結合位點,可以發揮協同作用,進而提高治療效果。這種結構設計能有效地改善抗體藥物在體內的藥物代謝動力學過程,增強臨床治療效果。然而,設計出療效好、穩定性高且利于生產的BsAb仍需深入研究。
近年來上市的抗體藥物反映了下一代抗體藥物開發的新趨勢:第一個方向是讓抗體藥物具有更小的分子量,以便具有更好的藥代動力學和藥效學參數,更便于大規模制造,比如Fab片段、Fab'片段、F(ab')2片段、單鏈抗體(scFv)、單區抗體(sdAb)、雙鏈抗體(diabody)、三鏈抗體(triabody)和微小型抗體(minibody);第二個方向是根據已知的藥物分子,將至少兩個具有某種生物功能的分子連接在一起形成融合蛋白,比如雙特異性抗體、三功能抗體(trifunctional antibody)、合成抗體(synbody)、抗體-藥物偶聯物(ADC)。
抗體-藥物偶聯物由單抗與有治療作用的小分子藥物兩部分構成,借助抗體實現化學藥物對腫瘤組織的靶向遞送。抗體-藥物偶聯物在血液中穩定性高,藥物分子不會脫落,因而毒副作用較小,但對腫瘤細胞的抑制作用遠遠高于裸抗體。這種設計策略既可提高抗體藥物的殺傷能力,又提高小分子化學藥物的治療窗。
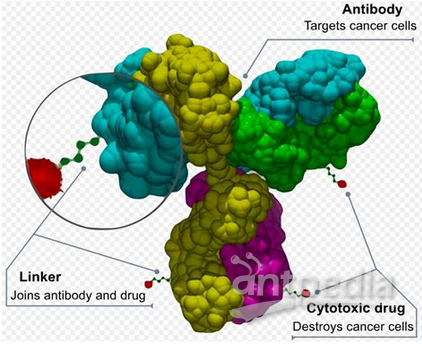
抗體-藥物偶聯物,圖片來自Wikipedia。
單抗藥物為多種疾病的治療提供了新的途徑,目前單抗藥物已廣泛應用于腫瘤等多種疾病的臨床治療。從國內單抗抗腫瘤藥物研發流程來看,主要分為靶點發現、靶點選擇、抗原制備、單克隆抗體制備技術的選擇以及抗體功能鑒定5個部分。在各個環節中,可以通過不同環節的技術特點發現影響研發成果的風險因素,找到風險因素,并運用風險管理的思維和方法進行分析。單抗藥物制備過程中采用的不同技術,都會遇到不同的挑戰。為此,這就需要開發者針對具體問題進行具體分析,不斷克服這些技術挑戰,方能開發出真正有用的單抗藥物,為患者帶來新的救命藥。
2024年6月25日,國家藥監局網站顯示,一款由中國原研的結直腸癌靶向新藥恩立妥?(西妥昔單抗β注射液)獲批準上市,填補了我國結直腸癌的EGFR靶向抗體藥物近20年來僅有進口藥物,而缺乏國產品種的空白......
6月14日,記者從科興控股獲悉,其投資企業興盟生物研發的一類創新藥克瑞畢獲批可用于成人狂犬病病毒暴露后的被動免疫治療。據介紹,該產品為國內首個符合世界衛生組織推薦的抗狂犬病雞尾酒抗體,其獨特的“雞尾酒......
近日,我國科研人員在HAdV-55單克隆中和抗體研究方面取得新進展。相關成果發表于國際期刊《新發病原微生物與感染》(EmergingMicrobes&Infections)。人腺病毒(Huma......
在2023年的中國生物技術創新大會上,天府錦城實驗室正式發布了其全球生物醫藥青年人才策源計劃的第二批5個項目榜單。這一行動是為了廣泛邀請海內外的優秀團隊來參與并解決這些挑戰。天府錦城實驗室是四川省政府......
2023年3月23日,由中航環宇生物醫藥咨詢平臺、北京中航環宇國際文化交流中心、中國疫苗與抗體藥物創新國際論壇組委會聯合主辦的“2023第四屆北京疫苗與抗體藥物創新國際論壇”在北京開幕。2023第四屆......
2023年3月18日,2023EBC第八屆易貿生物生產大會暨易貿生物產業展覽在春日的金雞湖畔隆重開幕。2023EBC第八屆易貿生物生產大會暨易貿生物產業展覽2023EBC設有技術服務、卓越品牌、原料/......
近日,復旦大學基礎醫學院醫學分子病毒學教育部/衛健委重點實驗室、上海市重大傳染病和生物安全研究院應天雷教授團隊與復旦大學附屬眼耳鼻喉科醫院洪佳旭副主任醫師團隊攜手,成功開發出新一代高穩定性人工合成抗體......
一塊人造晶體,上面吸附著抗體,在強力藥物或顯像劑的協助下,精確地找出病變細胞,并減少對患者的不良影響——這并非科幻小說中才出現的情況,而是由澳大利亞和奧地利科學家研制出的世界首款金屬有機框架(MOF)......
中新網上海12月7日電(孫國根陳靜)記者7日獲悉,中國專家成功開發出新一代高穩定性人工合成抗體藥物平臺,并針對眼科常見病角膜新生血管病和脈絡膜新生血管病成功改造出有效抗體藥物。復旦大學基礎醫學院醫學分......
日本藥企協和麒麟(KyowaKirin)近日宣布,評估抗體藥物KHK4083治療中度至重度特應性皮炎(AD)成人患者的2期研究達到了主要終點。KHK4083是一種潛在同類首款(first-in-cla......