病例1
臨床資料
患者,男,60歲,主因"慢性腎功能不全尿毒癥期"于2015年12月20日入院。尿毒癥病史8年,原發病原因不清,無特殊。患者術前診斷:(1)慢性腎功能不全(尿毒癥期)、腎性貧血、繼發性甲狀旁腺機能亢進癥;(2)糖尿病">2型糖尿病;(3)高血壓Ⅲ級(極高危);(4)腹主動脈、雙側髂總動脈及髂內外動脈多發鈣化斑;(5)胃炎伴糜爛;(6)冠狀動脈粥樣硬化性心臟病。2015年12月20日行同種異體腎移植手術。供者為44歲男性,原發病為高血壓導致的腦血管意外,末次肌酐為190 μmol/L。術前注射用巴利昔單抗免疫誘導(術前、術后第4天分別予以20 mg),術后應用環孢素+麥考酚鈉腸溶片+強的松。術后出現移植腎功能延遲恢復(delayed graft function,DGF),給予規律血液透析、抗感染、控制血糖、抗排斥等對癥支持治療。術后第7天,患者出現移植腎區疼痛,彩色超聲及CT示移植腎腫大、腎周血腫,血紅蛋白下降,考慮移植腎破裂可能。急診行移植腎探查術,術中見移植腎腫大,未見腎破裂。探查術后給予即復寧100 mg/d,共6 d。術后2周,患者尿量增加,肌酐下降,停止血液透析。術后3周,患者口腔出現大片潰瘍,伴低熱。胸部CT示右下肺少許炎癥,咽拭子革蘭氏陽性球菌++、革蘭氏染色查真菌+。治療方案為停用麥考酚鈉腸溶片,給予科賽思、穩可信等抗感染以及支持治療。治療效果欠佳,患者持續發熱,最高體溫39.5℃,伴咳嗽、咳痰,肺部CT提示感染持續加重,病灶進行性擴大(圖1)。
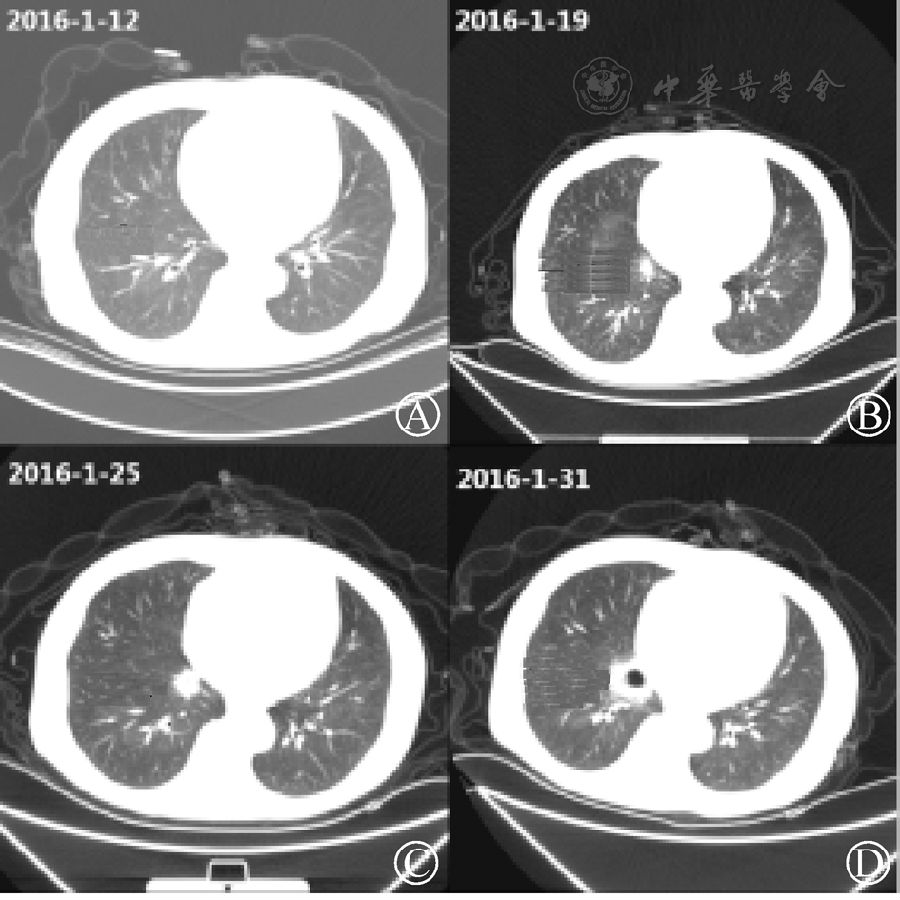
圖1 患者肺部CT示肺部感染持續加重,病灶進行性擴大
多次行EB病毒、巨細胞病毒、G實驗、GM實驗以及隱球菌感染檢查,未見明顯陽性結果。2016年2月4日纖維支氣管鏡檢查以及肺泡灌洗示(病理)送檢支氣管黏膜急慢性炎癥,并見纖維素樣滲出及較大量含鐵血紅素細胞,提示陳舊性出血。細菌以及真菌培養未見明顯異常。繼續支持治療,維持小劑量免疫抑制劑,改科賽斯為伏立康唑抗真菌治療,CT提示肺部病灶逐漸縮小(圖2),患者病情開始好轉。
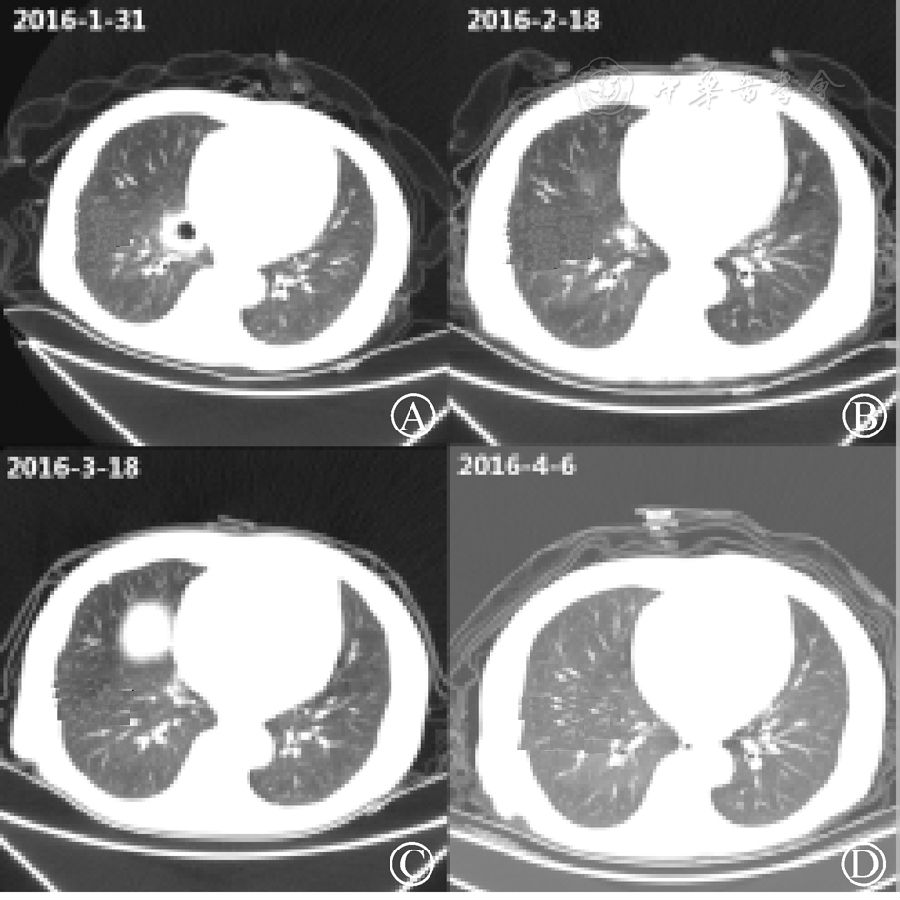
圖2 患者肺部病灶逐漸縮小
2016年3月3日患者行切口二期縫合。2016年4月12日患者出院,體溫正常,肺部CT正常,肌酐79 μmol/L,血紅蛋白169 g/L。病例特點:老年男性,基礎疾病多,糖尿病,心肺功能不佳,術后DGF,腎功能恢復不佳,發生嚴重急性排斥反應,需使用強效抗排斥藥物(ATG)。經過3次手術,術后免疫功能低下,嚴重口腔潰瘍,肺部混合發生細菌、病毒以及真菌感染。
專家討論
專家一:心臟死亡器官捐獻(DCD)供腎腎移植術后DGF發生率較高,且DGF治療過程中容易出現排斥反應、免疫抑制劑中毒、感染等并發癥,治療過程中需兼顧抗排斥及抗感染治療,同時加強支持治療。DCD供腎腎移植術后圍手術期內感染發生率較高,可能由于供者長期臥位、昏迷、低蛋白血癥、全身感染等情況造成菌血癥或膿毒血癥。在條件允許的情況下,供腎摘取前最好對供者的血、痰、尿以及移植腎灌洗液等標本進行細菌培養,術后選擇敏感抗菌藥物進行治療,預防輸入性感染。術后患者一旦懷疑肺部感染,應積極予以患者肺部CT檢查,避免胸片漏報。
專家二:患者老年男性,免疫風險為低免疫水平,ATG-F應用時間長且總劑量較大。該患者是否為排斥反應,無病理學證據。DCD供腎DGF發生率高,移植腎出現DGF亦會出現超聲血流阻力高、腎臟腫大表現。使用ATG-F時,應同時減用免疫抑制劑劑量,該患者使用環孢霉素,應予以減量,這樣可以減輕藥物對腎臟的損害。對于曲霉菌肺炎的治療,可予以兩性霉素B治療,效果明顯。對于術后不排除肺部感染的患者,建議予以肺部CT檢查,部分情況胸片不易診斷。
專家三:科賽斯對曲霉菌治療效果有限,可予以患者兩性霉素B治療,治療過程注意加用激素,從小劑量開始治療,逐漸加量。
專家四:移植腎出現血腫不是移植腎進行活檢的禁忌,出現血腫后行腎臟穿刺檢查基本安全,移植腎活檢對于臨床治療指導意義重大。我中心曾有1例患者,術后出現移植腎血腫(血腫大于15cm),對移植腎活檢后發現并無移植腎排斥,而是缺血再灌注后間質水腫。對于曲霉菌的治療,可用兩性霉素B,不確定為曲霉菌感染時,可試驗性使用兩性霉素B診斷性治療。
專家五:患者術后移植腎功能不恢復,不排除以下3種原因:(1)排斥;(2)術后血腫壓迫血管;(3)DGF。患者可以耐受的情況下應予以患者積極活檢,可指導術后治療。
病例2
臨床資料
供體女性,37歲,死亡原因為腦外傷。ICU搶救6 d。無原發病,無心肺復蘇。獲取前肌酐90 μmol/L,獲取前尿量100 ml/h。無低血壓。熱缺血時間為0 min,冷缺血時間為8 h。
供受雙方血型均為B(+),人類白細胞抗原(HLA)匹配情況見表1。2014年2月12日HLA抗體檢測為陽性,群體反應性抗體(PRA)30%。抗體特異性分析:抗HLA-DR:1、4、7、8、9、10、11、12、17、18。DR8陽性。2015年12月25日Luminex查PRA:DR:7、9、12、15,DRW:52,DQ:2、5、6、7,DQ5陽性。患者自述DQ5陽性,說明患者本身存在抗自身抗體。受體與供體DCD陰性。供體特異性抗體(DSA):DQB1*02:02 ,BCM 12043。
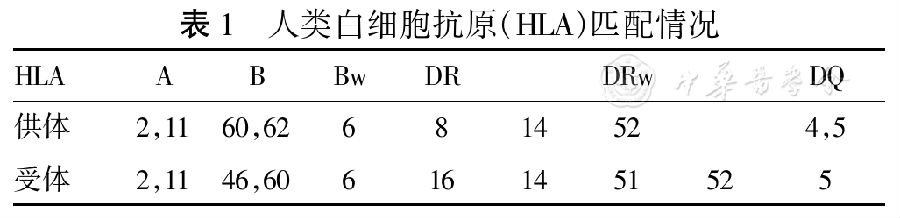
表1 人類白細胞抗原(HLA)匹配情況
供腎零點活檢(圖3)穿刺示小球無明顯硬化,間質區腎小管變性壞死明顯,但是無明顯基底膜塌陷和自溶。熒光(圖4)可見免疫沉積物,但無明顯特異性。零點活檢評估內容:(1)供腎:是否可用—纖維化程度的評估;是否存在可疑的活動性病變—確認;可疑腫瘤的評估—良惡性與類型;血壓和年齡對腎小球硬化與萎縮的影響。(2)缺血-再灌注腎損傷的評估;近曲腎小管的改變(急性壞死/ATN);腎小管上皮扁平與TBM裸露;腎小球的改變。供腎評估要求:(1)標本的要求:至少25個腎小球和2條動脈;(2)腎小球硬化范圍:>20%;(3)動脈硬化程度:>25%;(4)間質纖維化與腎小管萎縮;(5)腎小球和動脈內血栓(膽固醇性栓子為禁忌)。供腎評估報告(參照Remuzzi分級):(1)穿刺類型:皮質、髓質、楔形/細針;(2)腎小球數量與腎小球硬化范圍;(3)動脈數量與動脈內膜纖維化或玻璃樣變范圍;(4)腎小管萎縮和間質纖維化范圍;(5)腎小球和血管內血栓。本例供腎病理評估為2分。腎小球硬化率:5/23=21.7%;腎小球(g0-1);腎間質炎癥(i1);腎小管萎縮(t0-1);腎小管Rbc管型;個別小動脈(v0-1);免疫熒光(IF):多項弱表達。從形態上看,腎小球病變輕,但伴腎小球硬化(21.7%);腎小管紅細胞管型,提示可能在ICU期間存在急性腎損傷(AKI)。從IF看:多種抗體與補體弱表達,特異性低。可能為隨年齡增加發生的退行性變;不完全除外供者繼發性免疫復合物沉積性腎炎/自身免疫性疾病。
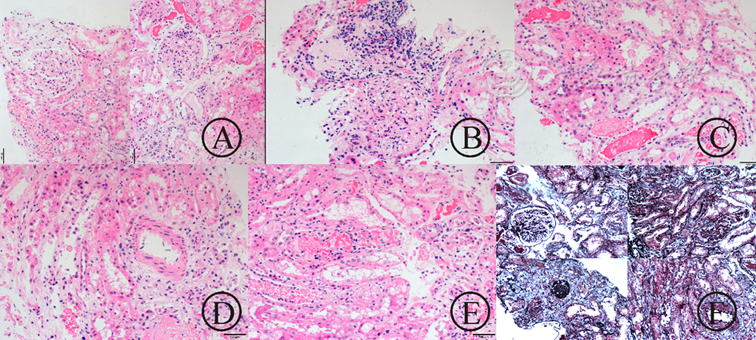
圖3 2016年7月4日零點穿刺,HE染色示腎小球無明顯硬化,間質區腎小管變性壞死明顯,但是無明顯基底膜塌陷和自溶
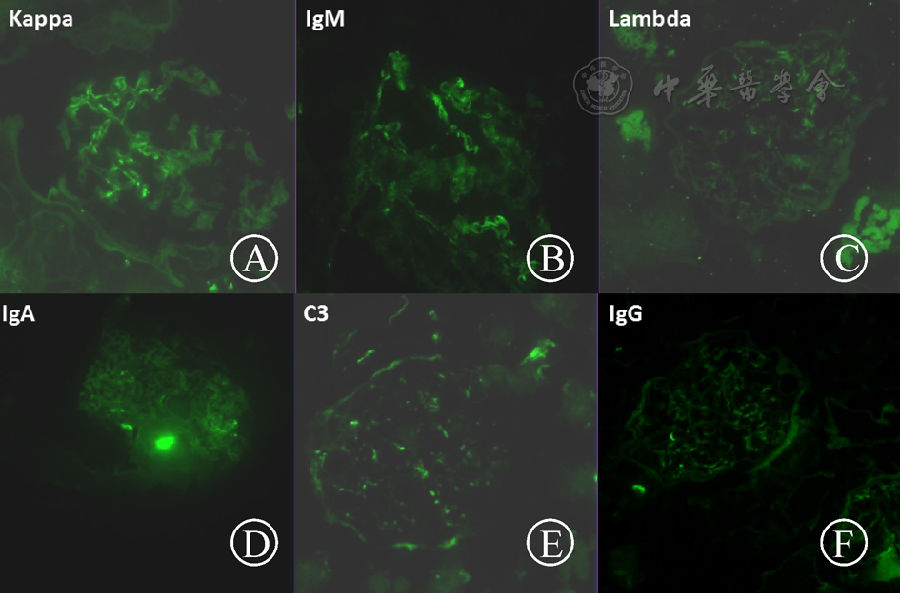
圖4 熒光下可見免疫沉積物,但無明顯特異性
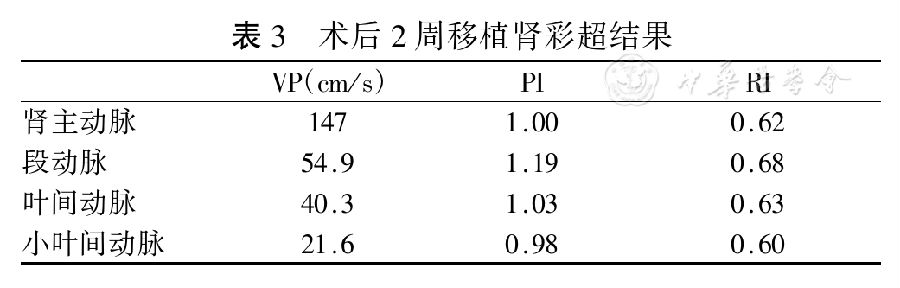
受者,女性,36歲。原發病:慢性腎小球腎炎(無活檢),2002年首次移植,移植腎失功(無活檢)。透析方式:血液透析(2年),術前PRA30%(ELISA法),術前肌酐912 μmol/L,MM錯配2個。既往有慢性乙肝、丙肝(病毒均無復制),手術日期2016年7月4日。血管吻合方式:供腎動、靜脈與受體髂外動、靜脈端側吻合。輸尿管吻合方式:輸尿管全層與膀胱黏膜吻合,肌層包埋。術后免疫抑制治療及恢復情況(表2)。患者術后出現DGF,術后2周尿量逐漸正常。肌酐緩慢下降出院。群體反應性抗體系列檢測:術后第12天復查PRA:HLA抗體檢測:陽性,PRA:30%,抗體特異性分析:抗HLA-DR:1、4、7、8、9、10、11、12、17。其中HLA-DR8與供者相同。術后2周移植腎彩超(表3)示移植腎長徑13.7 cm,短徑5.8 cm,寬徑6.0 cm;移植腎輪廓清,形態稍大,表面光滑,實質回聲強,集合系統未見分離暗區,移植腎中上段前方顯示夜行暗區,范圍約8.5 cm×2.7 cm,透聲差。彩色多譜勒血流圖:血管樹走向清晰,血流充盈尚可,大致正常。超聲提示移植腎回聲增強,請結合臨床;移植腎周包裹性積液,建議追蹤觀察。

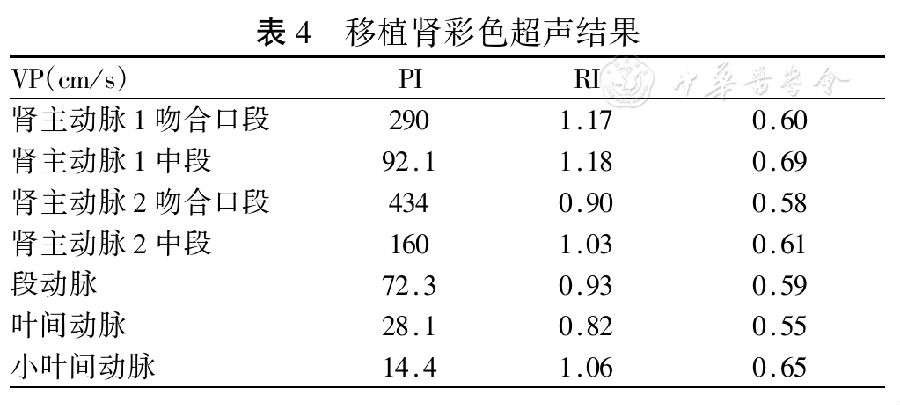
出院時免疫抑制方案:普樂可復4 mg/d,嗎替麥考酚酯1250 mg/d,強的松12 mg/d。出院后2周(即術后約6周)出現血肌酐、尿蛋白增高。移植腎超聲示吻合口流速高(表4)。移植腎超聲示移植腎長徑12.0 cm,短徑5.0 cm,寬徑5.2 cm;移植腎輪廓清,形態稍大,表面光滑,實質回聲強,集合系統未見分離暗區,移植腎中上段前方顯示液性暗區,范圍約6.5 cm×2.1 cm,透聲差。彩色多譜勒血流圖示血管束走向清晰,血流充盈尚可。腎主動脈似見2處吻合口起源于髂血管,上支較細小,吻合口段血流速度均呈五彩鑲嵌狀高速射流。超聲提示移植腎主動脈吻合口段血流速度明顯增快,與前比較變化不大,建議密切追蹤觀察;移植腎周包裹性積液,與前比較變化不大,建議追蹤觀察。2016年8月23日血肌酐升高至184.9 μmol/L,2016年8月27日采用MP沖擊治療500 mg、250 mg、250 mg。血肌酐未見明顯下降,波動于170~190 μmol/L。2016年9月13日復查PRA:HLA-Ⅱ類陽性21%(DR:9、15;DQ:2、4、5、6),DR5陽性。
2016年10月10日移植腎穿刺(圖5)可見局灶性硬化,淋巴細胞浸潤,腎小球大致正常,血管壁、管腔無明顯異常。小管上皮細胞變性壞死,可見程度很輕的小管炎。可見條紋狀纖維化,非特異性改變。病理報告示腎小管間質損傷:灶性腎小管炎(1~2個淋巴細胞);條帶狀間質纖維;間質內灶性單一核細胞浸潤。腎小球病變輕微,個別炎細胞浸潤。個別間質內小動脈內膜輕度增厚,間質小靜脈小管周毛細血管炎明顯。免疫熒光(圖6):細顆粒狀熒光物沉積于腎小球毛細血管壁,IgM(±~+),IgA、IgG、Kappa、Lambda、Fib、C1q、C3、C4、C4d及TGFβ-1均(-)。免疫組化:LCA(+),CD3(T淋巴細胞+),CD4及CD8(T細胞+,CD8稍多于CD4);CD19及CD20(B淋巴細胞-);CD68(組織細胞+);CD34(血管+)。(移植腎)傾向考慮急性T淋巴細胞介導的排斥反應(IA型)。
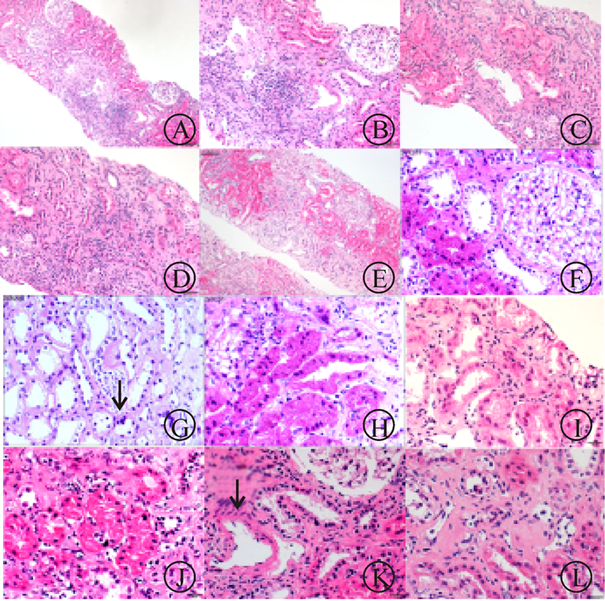
圖5 2016-10-10移植腎穿刺:可見局灶性硬化,淋巴細胞浸潤,腎小球大致正常,血管壁、管腔無明顯異常。小管上皮細胞變性壞死,可見程度很輕的小管炎。可見條紋狀纖維化,非特異性改變。
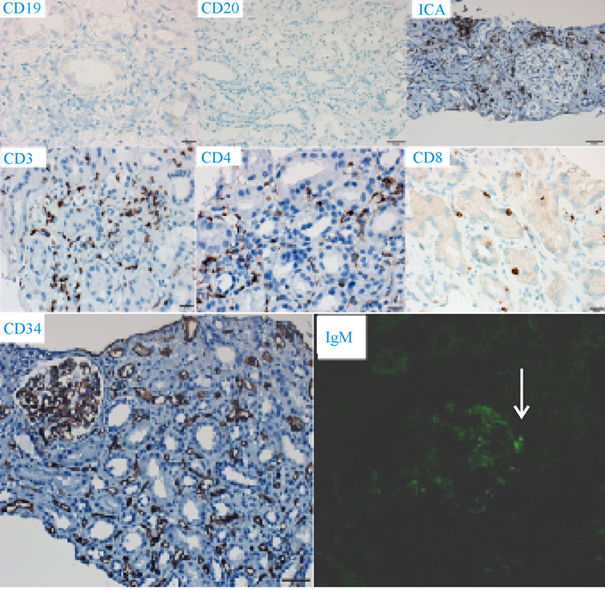
圖6 免疫組化及熒光結果,免疫組化:LCA(+),CD3(T細胞+),CD4及CD8(T淋巴細胞+,CD8稍多于CD4);CD19及CD20(B淋巴細胞-);CD68(組織細胞+);CD34(血管+)。免疫熒光:細顆粒狀熒光物沉積于腎小球毛細血管壁,IgM(±~+),IgA、IgG、Kappa、Lambda、Fib、C1q、C3、C4、C4d及TGFβ-1均(-)。
進行病毒檢測,除外藥物中毒及皰疹病毒感染可能。最終診斷分析考慮為排斥:急性T淋巴細胞介導排斥反應,局灶性小管炎,間質炎癥反應:0~25%。該患者術后Tac谷濃度均低于10 ng/ml進一步查病毒相關檢查均陰性,單純皰疹病毒1型(人類皰疹病毒1型),單純皰疹病毒2型(人類皰疹病毒2型),水痘帶狀皰疹病毒(人類皰疹病毒3型),EB病毒(人類皰疹病毒4型),巨細胞病毒(人類皰疹病毒5型),BK病毒。最終診斷:急性T淋巴細胞介導的排斥反應(ⅠB)。2016年10月21日血肌酐升高至255 μmol/L,2016年10月22日開始實施MP沖擊:500 mg、250 mg、250 mg。血肌酐波動在180~220 μmol/L。2016年10月21日免疫抑制方案調整為:普樂可復2 mg/d,西羅莫司0.5 mg/d,嗎替麥考酚酯1 000 mg/d,強的松4 mg/d。予以患者IVIG治療后1個月,肌酐維持160 μmol/L,患者拒絕再次穿刺。
對側腎受體一般情況介紹:受者,男性,37歲,原發病為慢性腎小球腎炎(未穿刺證實),既往血液透析4年,術前PRA陰性,術前肌酐1 106 μmol/L,MM錯配4個。手術日期為2016年7月4日。免疫誘導方案:ATG-F(100 mg)×5支+注射用巴利昔單抗(20 mg)×2支。圍術期甲強龍用量為2 g。術后早期口服免疫抑制劑方案:普樂可復+麥考酚鈉腸溶片+強的松。血肌酐降至最低值時間37 d。術后血肌酐最低值74 μmol/L。既往乙肝病史(有復制)。
專家討論
專家一:T淋巴細胞介導的排斥反應促發了新生DSA的形成。一項針對315例術前DSA陰性的腎移植受者的分析顯示,新生DSA陽性組受者在DSA形成前急性排斥反應發生率顯著高于DSA陰性組。急性排斥反應促發了DSA的形成。T淋巴細胞介導的排斥反應,因T淋巴細胞的活化γ干擾素釋放增加,刺激移植物內皮細胞HLA表達增加,B淋巴細胞在識別抗原后分化為漿細胞,從而產生新生針對供者HLA的特異性抗體DSA。供者特異性抗體在移植領域越來越受到重視。移植領域對供者特異性抗體(DSA)的認知及研究已有數十年的歷史,而隨著研究的深入,DSA在移植領域越來越受到重視。DSA是指移植后在受者體內產生的針對供者人類白細胞抗原(HLA)的特異性抗體。早在1966年,Kissmeyer NF等人發現超急性排斥反應與預存DSA顯著相關。1970年,Jeannet等人發現腎移植術后早期即可產生DSA。在20世紀90年代,Halloran等人初步提出了DSA對移植物的損傷機制,DSA與移植物HLA抗原結合后激活補體,介導炎癥細胞反應產生損傷。而目前,大量的研究顯示,DSA增加抗體介導的排斥反應(AMR)風險,AMR是導致移植物丟失的關鍵原因,并且在2013年國際移植學會推出了DSA檢測指南。
T淋巴細胞介導性排斥反應可以同時伴有本分級中的2、5和6。急性T淋巴細胞介導性排斥反應分級ⅠA:具有明顯的腎組織間質炎性細胞浸潤(>25%的腎組織被累及,i2或i3)并局灶性中度腎小管上皮炎(t2);ⅠB:具有明顯的腎組織間質炎性細胞浸潤(>25 %的腎組織被累及,i2或i3)并局灶性重度腎小管上皮炎(t3);ⅡA:具有輕度至中度動脈內膜炎(v1);ⅡB:具有重度的動脈內膜炎致>25%的動脈管腔狹窄(v2);Ⅲ:具有透壁性動脈炎和/或動脈管壁中層平滑肌纖維素樣壞死并伴有動脈管壁淋巴細胞浸潤(v3)。
專家二:早期對于DSA介導排斥要求C4d陽性,但是2013banff標準已經撤銷,但是外周血DSA應為陽性。一項有622例患者入選的研究共進行796次穿刺,發現11.1%DSA陰性患者及11.6%DSA陽性患者,光鏡下均未見抗體介導排斥表現。追問患者電鏡結果顯示無明顯內皮腫脹,移植美國移植年會會議報道電鏡:內皮細胞腫脹,足細胞消失,內皮下擴張,管周毛細血管多層提示抗體介導排斥。患者二次移植,DQ陽性,對于抗體介導排斥,DQ較DR風險高。
專家三:患者移植腎穿刺可見局灶硬化,不排除與穿刺部位選擇有關,若條件允許予以更換穿刺點。移植腎超聲顯示血管流速快,是否存在血供問題仍不能排除。建議予以患者再次移植腎穿刺。雷帕霉素對移植腎增生的保護作用明確,但是雷帕霉素學習曲線長,不易掌握濃度,其對移植腎的生存期影響尚不明確。