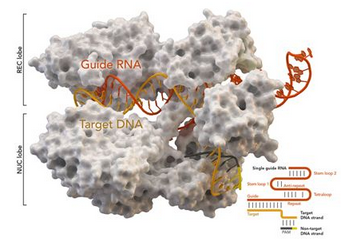
基因組編輯技術CRISPR/Cas9被《科學》雜志列為2013年年度十大科技進展之一,受到人們的高度重視。CRISPR是規律間隔性成簇短回文重復序列的簡稱,Cas是CRISPR相關蛋白的簡稱。CRISPR/Cas最初是在細菌體內發現的,是細菌用來識別和摧毀抗噬菌體和其他病原體入侵的防御系統。
圖片來自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
2018年11月26日,中國科學家賀建奎聲稱世界上首批經過基因編輯的嬰兒---一對雙胞胎女性嬰兒---在11月出生。他利用一種強大的基因編輯工具CRISPR-Cas9對這對雙胞胎的一個基因進行修改,使得她們出生后就能夠天然地抵抗HIV感染。這也是世界首例免疫艾滋病基因編輯嬰兒。這條消息瞬間在國內外網站上迅速發酵,引發千層浪。有部分科學家支持賀建奎的研究,但是更多的是質疑,甚至是譴責。
即將過去的8月份,有哪些重大的CRISPR/Cas研究或發現呢?小編梳理了一下這個月生物谷報道的CRISPR/Cas研究方面的新聞,供大家閱讀。
1.Science:重大突破!CRISPR-Cas系統新用途!開發出可編程的CRISPR反應性智能材料
doi:10.1126/science.aaw5122; doi:10.1126/science.aay4198
CRISPR-Cas系統已成為科學家們在不斷增加的有機體中研究基因的首選工具,并且正被用于開發潛在地校正基因組中單個核苷酸位點上的缺陷的新型基因療法。它也被用于正在進行的診斷方法中,用于檢測患者體內的病原體和致病突變。
如今,在一項新的研究中,來自美國哈佛大學威斯生物啟發工程研究所和麻省理工學院的研究人員展示了將CRISPR用作新型刺激反應性“智能(smart)”材料的控制元件。一旦被特定的天然的或用戶定義的DNA刺激物激活,一種CRISPR-Cas酶就能夠讓多種智能材料釋放出自身結合的貨物,比如染料和活性酶,改變它們的結構來部署包埋的納米顆粒和活細胞,或者調節電路從而將生物信號轉化為電信號。相關研究結果發表在2019年8月23日的Science期刊上,論文標題為“Programmable CRISPR-responsive smart materials”。

圖片來自Science, 2019, doi:10.1126/science.aaw5122。
論文通訊作者、哈佛大學威斯生物啟發工程研究所創始核心學院成員James Collins博士說,“我們的研究表明CRISPR的力量可以在實驗室之外用于控制DNA反應性材料的行為。我們開發了一系列具有不同能力的材料,這就突顯了可編程的CRISPR反應性智能材料(CRISPR-responsive smart material)所支持的應用范圍。這些應用包括新型治療診斷策略、即時診斷以及對流行病爆發和環境危害進行的區域監測。”
論文共同第一作者、麻省理工學院研究生Max English說,“我們將單鏈靶DNA序列整合到聚合物材料中,要么作為懸垂貨物的錨點,要么作為維持材料基本完整性的結構元件,并且能夠通過提供Cas12a和一種作為刺激物的特定gRNA來控制不同的材料行為。”
2.Biomaterials:開發出一種無載體的多重基因編輯系統,可用于抗癌免疫療法
doi:10.1016/j.biomaterials.2019.119298
在一項新的研究中,韓國科學技術研究院(KIST)的Mihue Jang博士及其團隊和韓國世宗大學的Seokmann Hong教授及其團隊開發出一種新的基因編輯系統,而且這種系統可同時抑制淋巴瘤細胞表面上表達的干擾免疫系統的蛋白和激活細胞毒性T淋巴細胞,因而可以用于抗癌免疫治療中。相關研究結果近期發表在Biomaterials期刊上,論文標題為“A carrier-free multiplexed gene editing system applicable for suspension cells”。
基因編輯技術通過移除特定基因或編輯基因以恢復其正常功能來消除疾病的根本原因和治療疾病。特別地,CRISPR基因編輯技術如今經常用于免疫療法中,通過校正免疫細胞中的基因來誘導它們選擇性地攻擊癌細胞。
Jang博士改進了CRISPR基因編輯系統,使得在沒有外部載體的情況下能夠讓這種基因編輯系統穿過細胞膜(ACS Nano, 2018,12,8,7750-7760)。然而,存在多個調節免疫活性的基因,而且誘導安全、便捷的免疫治療技術尚未充分開發。通過合作,Jang團隊和Hong團隊進一步改進這種CRISPR基因編輯系統,開發出一種適用于免疫治療的技術,從而允許在沒有外部載體的情形下將基因轉移到淋巴瘤細胞中,同時實現校正多個基因的目的。
3.Nature子刊:利用免疫正交直向同源物有望提高CRISPR-Cas9基因組編輯效率
doi:10.1038/s41551-019-0431-2
鑒于CRISPR-Cas9的功效和高通量能力,它引發了基因組編輯領域的變革。一項利用CRISPR-Cas9介導的基因組編輯的臨床試驗于今年年初開始,并且還將有更多的臨床試驗。然而,人們仍然關注Cas9蛋白在人體中的潛在免疫原性,特別是腺相關病毒(AAV)載體介導的Cas9遞送在體內的應用。最近,幾個獨立的研究團隊報道了人體對Cas9蛋白的免疫力早已存在。幸運的是,科學家們在自然界中發現了來自不同細菌物種的幾種Cas9變體(Cas9的直向同源物)。

圖片來自Nature Biomedical Engineering, 2019, doi:10.1038/s41551-019-0431-2。
考慮到這些因素,Moreno及其同事們在一項新的研究中,通過預測Cas9變體和AAV各自的氨基酸序列對主要組織相容性復合物I型(MHCI)和II型(MHCII)的結合能力來分析它們的免疫正交性(immune-orthogonality)。通過使用Cas9和AAV的免疫正交直向同源物(immune-orthogonal ortholog),它們在預先接受Cas9蛋白免疫的動物中實現了高效的基因組編輯。有趣的是,預先免疫僅導致編輯效率的部分降低,這表明抗Cas9適應性免疫應答在體內的影響是有限的。
然而,這項研究的一個重要限制是使用與人類相比具有有限MHC譜系的近交小鼠。這些研究人員承認,鑒于不同AAV衣殼之間的高度保守性和人群中眾多MHC免疫基因的存在,使用免疫正交直向同源物可能是降低人類抗衣殼免疫原性的一個較差的解決方案。Cas9在體內的使用可能存在類似的限制。然而,細菌中Cas9的進化具有較長的歷史,并且每個月從不同的細菌菌株中分離出新的Cas9變體。降低對Cas9產生適應性免疫應答的風險的另一種可能的解決方案是通過mRNA或蛋白遞送實現Cas9核酸酶的瞬時表達。
4.Nat Commun:首次利用CRISPR從活動物基因組中清除HIV
doi:10.1038/s41467-019-10366-y
坦普爾大學劉易斯·卡茨醫學院(LKSOM)和內布拉斯加大學醫學中心(UNMC)的研究人員進行了一次重大合作,首次從活動物的基因組中消除了可復制的HIV-1 DNA,這是一種導致艾滋病的病毒。這項研究于近日在線發表在《Nature Communications》雜志上,它標志著人類艾滋病病毒(HIV)感染可能治愈的關鍵一步。
"我們的研究顯示,先后進行抑制艾滋病毒復制的治療和基因編輯療法可以從感染動物的細胞和器官中消除艾滋病毒。" Kamel Khalili博士說道,他是LKSOM的Laura H. Carnell教授、神經科學系主任、神經病毒學中心主任、綜合神經艾滋病中心主任。Khalili博士和傳染病和UNMC內科教授、藥理學和實驗神經科學系主任、神經退行性疾病中心主任Howard Gendelman博士是這項新研究的通訊作者。
在之前的工作中,Khalili博士的團隊使用CRISPR-Cas9技術開發了一種新的基因編輯和基因治療傳遞系統,旨在從HIV病毒的基因組中去除DNA。在大鼠和小鼠中,他們發現基因編輯系統可以有效地從感染細胞中去除大量的HIV DNA片段,顯著影響病毒基因的表達。然而,與ART類似,基因編輯本身不能完全消除艾滋病毒。
在這項新研究中,Khalili博士和同事們將他們的基因編輯系統與最近開發的一種名為長效緩釋(激光)技術的治療策略相結合。激光技術是由Gendelman博士和UNMC藥理學助理教授Benson Edagwa博士共同開發的。激光抗逆轉錄病毒治療以病毒避難所為目標,在較長時間內維持低水平的艾滋病毒復制,從而降低抗逆轉錄病毒治療的頻率。由于抗逆轉錄病毒藥物的化學結構發生了藥理學上的變化,這些長效藥物得以問世。這種經過修飾的藥物被包裝成納米晶體,納米晶體很容易分布到HIV可能潛伏的組織中。從那里,儲存在細胞內數周的納米晶體慢慢釋放藥物。
研究人員用老鼠來制造易受HIV感染的人類T細胞,允許長期的病毒感染和ART誘導的潛伏期。一旦感染被確定,小鼠接受激光治療,隨后使用CRISPR-Cas9治療。在療程結束時,對小鼠進行病毒載量檢測。分析顯示,大約三分之一的感染艾滋病毒的小鼠體內的艾滋病毒DNA完全消失。
5.Nature:科學家用CRISPR成功治療肌營養不良癥
doi:10.1038/s41586-019-1430-x
來自加拿大、美國和瑞典的一組研究人員發現,在肌營養不良小鼠模型中,編輯一個參與產生促進肌肉力量的蛋白質的基因可以減輕癥狀。在他們發表在《Nature》雜志上的論文中,該小組描述了他們對老鼠的實驗以及他們從中學到的新知識。
肌營養不良是一種遺傳性疾病,在這種疾病中,肌肉質量會減弱,導致機體虛弱,最終導致殘疾。此前的研究表明,這種疾病由一種名為Lama2的基因突變引起。這種基因突變會導致無法產生肌肉正常生長需要的蛋白質。它還會破壞神經髓鞘,導致神經損傷。到目前為止,靶向該基因的努力并沒有給患者帶來多大的改善。在這項新的研究中,研究人員采用了一種新的方法--編輯相關基因。
與之相關的基因被稱為Lama1,它也參與了肌肉生產和發育過程中蛋白質的生成。但與Lama2不同的是,它可以通過基因調整編輯促進增加另一個叫做laminin-α1的蛋白質的生產,也可以促進肌肉組織的生成。這項新研究的研究人員在小鼠模型上嘗試了這種方法。他們指出,要做到這一點,需要使用CRISPR來開發一個基因激活系統,該系統能夠處理參與這一過程的大型病毒載體,而這個過程不會在螺旋結構中產生DNA雙鏈斷裂。
研究人員報告說,在老鼠身上測試基因編輯技術顯示出積極的結果。小鼠的纖維化程度有所降低,肌纖維體積增大,這在某些情況下減少或阻止了癥狀的發生。他們還發現,治療因疾病而癱瘓的老鼠可以讓它們站起來走動。他們發現神經傳導速度也加快了,這是髓鞘破壞逆轉的跡象。
6.Nature子刊發布CRISPR-Cas重大進展:實現同時編輯幾十個基因!
doi:10.1038/s41592-019-0508-6
每個人都在談論CRISPR-Cas。這種生物技術提供了一種相對快速和簡單的方法來操縱細胞中的單個基因,這意味著它們可以被精確地刪除、替換或修改。此外,近年來,研究人員也一直在使用基于CRISPR-Cas的技術系統地增加或減少單個基因的活性。無論是在基礎生物學研究領域,還是在植物育種等應用領域,相應的方法都在很短的時間內成為了世界范圍內的標準。
迄今為止,在大多數情況下,研究人員只能用這種方法一次修改一個基因。有時,他們能一口氣做到兩三個;在一個特殊的情況下,他們能夠同時編輯7個基因。現在,位于巴塞爾的蘇黎世聯邦理工學院生物系統科學與工程系的Randall Platt教授和他的團隊已經開發出一種方法--正如他們在實驗中證明的那樣--可以同時修改細胞中25個目標基因位點。Platt認為這還不夠,他表示這個數字還可以進一步增加,增加到幾十甚至幾百個基因。無論如何,這種方法為生物醫學研究和生物技術提供了巨大的潛力。"多虧了這個新工具,我們和其他科學家現在可以實現我們過去只能夢想的事情。"
CRISPR-Cas方法需要一種稱為Cas的酶和一個小RNA分子。它的堿基序列就像一個"地址標簽",把酶精確地指向染色體上的指定作用位點。ETH的科學家們已經創造了一個質粒,,它存儲了Cas酶的序列和許多RNA地址分子,并按順序排列:換句話說,包含一個更長的地址列表。在他們的實驗中,研究人員將這種質粒插入人類細胞,從而證明了幾個基因可以同時被修改和調控。
對于這項新技術,科學家們并沒有使用目前大多數CRISPR-Cas方法中所使用的Cas9酶,而是使用了相關的Cas12a酶。它不僅可以編輯基因,還可以把長長的"RNA地址列表"同時切成一個個"地址標簽"。此外,Cas12a可以處理比Cas9更短的RNA地址分子。Platt說:"這些尋址序列越短,我們就能在質粒上找到越多的尋址序列。"
7.Science子刊:對特定的造血干細胞亞群進行CRISPR-Cas9基因編輯可有效逆轉多種血液疾病的癥狀
doi:10.1126/scitranslmed.aaw3768
在一項新的研究中,來自美國弗雷德哈欽森癌癥研究中心等研究機構的研究人員利用CRISPR-Cas9對長壽的造血干細胞進行編輯,從而逆轉在包括鐮狀細胞病和β地中海貧血在內的幾種血液疾病中觀察到的臨床癥狀。這是科學家們首次對成體造血干細胞中的一個特定亞群的遺傳組成進行特異性編輯,其中造血干細胞是血液和免疫系統中所有細胞的來源。相關研究結果近期發表在Science Translational Medicine期刊上,論文標題為“Therapeutically relevant engraftment of a CRISPR-Cas9–edited HSC-enriched population with HbF reactivation in nonhuman primates”。

在實驗室培養皿中即將接受CRISPR/Cas9基因編輯的造血干細胞的顯微圖,圖片來自Kiem lab / Fred Hutchinson Cancer Research Center。
這項原理驗證研究表明對靶向干細胞進行高效修飾可能會降低血液疾病和其他疾病的基因編輯治療成本,同時降低可能產生的副作用的風險。
論文通訊作者、弗雷德哈欽森癌癥研究中心干細胞與基因治療項目主任Hans-Peter Kiem說道,“通過展示如何針對一種疾病高效地編輯這個特定的細胞群體,我們希望對諸如HIV感染和一些癌癥之類的疾病使用這種相同的方法。”
8.Nat Commun:囊性纖維化治療新希望 科學家有望利用CRISPR-Cas技術剔除致病基因突變
doi:10.1038/s41467-019-11454-9
囊性纖維化是一種目前無法治愈的人類遺傳性疾病,而科學家們也一直在與其抗爭,特別是針對引發囊性纖維化的一些突變;近日,一項刊登在國際雜志Nature Communications上的研究報告中,來自特蘭托大學等機構的科學家們通過研究表示,他們或能利用基因編輯技術來推動CRISPR-Cas治療引發囊性纖維化的遺傳性問題。
相關研究結果有望為開發囊性纖維化新型療法開啟新的視角;囊性纖維化是由特殊的基因突變所引起,該基因能夠產生囊性纖維化跨膜傳導調節因子(Cftr),其功能異常會影響多個器官的功能,尤其是肺部,這項研究中,研究人員利用CRISPR-Cas基因編輯系統對引發囊性纖維化至少兩種類型的突變進行了永久性地編輯,該技術名為SpliceFix,因為其能在修復基因的同時恢復蛋白質的產生機制。
博士研究生Giulia Maule表示,我們基于CRISPR-Cas設計出了一種基因編輯策略,其能永久性地移除誘發疾病的兩種突變,CRISPR-Cas的工作原理類似于外科手術刀,其能以極高的準確率切斷突變的基因元件,這種修復策略或能對患者機體衍生的類器官進行高精準對地修復,其能夠僅靶向作用突變的序列,保留未突變DNA不受影響。
9.Nat Biotechnol:研究人員開發新的機器學習模型預測CRISPR-Cas9編輯人原代T細胞的結果
doi:10.1038/s41587-019-0203-2
在一項近日發表在《Nature Biotechnology》上、題為"Large dataset enables prediction of repair after CRISPR-Cas9 editing in primary T cells"研究中,來自Chan-Zuckerberg Biohub、斯坦福大學、加州大學等單位的研究人員在Alexander Marson、Andrew P. May和James Zou的帶領下,通過對基因編輯后的原代T細胞進行大規模測序獲得一個數據庫,并以此為基礎建立了一種機器學習模型來預測原代T細胞在CRISPR-Cas9基因編輯發后的基因修復。

原發性T細胞是一種很有希望用于治療性基因組編輯的細胞類型,因為它們可以在體外高效地進行工程設計,并可過繼轉移到患者身上。然而,目前還沒有關于cas9依賴編輯的原代人類T細胞基因組編輯結果的詳細信息。為此研究人員系統地描述了18例健康獻血者原發性T細胞中的化膿性鏈球菌Cas9 (SpCas9)的修復結果。
研究人員對1656個人類原始T細胞靶基因位點的修復結果進行排序,并利用這些數據來訓練一個機器學習模型,研究人員稱之為CRISPR修復結果(CRISPR Repair Outcome,SPROUT)。他們發現SPROUT可以準確預測核苷酸插入和刪除的長度、概率和序列,這將有助于對具有重要治療意義的原代T細胞的基因編輯過程中的SpCas9引導RNA的設計。
10.Nat Biomed Engin:科學家利用CRISPR-Cas9成功實現T細胞重編程 有望開發出新型抗癌療法
doi:10.1038/s41551-019-0409-0
從20世紀80年代開始,研究人員就提出了一種理念,即對患者自身的免疫細胞進行遺傳修飾使其有效抵御機體感染和腫瘤,但截至目前為止,修飾后的T細胞仍然無法像天然T細胞一樣有效發揮作用,這無疑限制了其在臨床中使用的價值。近日,一項刊登在國際雜志Nature Biomedical Engineering上的研究報告中,來自慕尼黑工業大學的科學家們通過利用新型的CRISPR-Cas9基因編輯工具成功對T細胞進行工程化修飾,使其更像機體生理性質的免疫細胞。
研究者Dirk Busch教授表示,這項研究中,我們利用基因剪刀CRISPR-Cas9技術首次開發出了與機體天然副本非常相似的修飾T細胞,其或能幫助解決很多臨床問題。常規的方法和新方法都能夠靶向作用T細胞受體,該受體位于細胞表面,其能識別病原體或腫瘤細胞相關的特殊抗原,以便T細胞進行攻擊;每一個受體都由兩種互聯的分子鏈組成,每一條鏈的遺傳信息都能被遺傳修飾產生新型手提,從而識別任何抗原,以這種方式,研究人員就能夠實現對T細胞的重編程。
常規方法的問題在于,新受體的遺傳信息會被隨機插入到基因組中,這就意味著,T細胞會由新舊受體同時產生,或者受體僅有一條舊鏈或一條新鏈;因此,細胞就并不會像機體天然的生理性T細胞一樣有效發揮作用了,而且其還會以不同的方式被控制,此外,鏈的混合還會誘發危險的副作用產生。研究者Kilian Schober解釋道,利用CRISPR技術,如今我們就能夠利用新的受體來完全替代天然受體,因為我們能夠將其插入到基因組中的相同位點,此外我們還能夠移除兩條鏈的信息以便不再摻入任何混合的受體。
4月3日,VertexPharmaceuticals(Nasdaq:VRTX)和CRISPRTherapeutics(Nasdaq:CRSP)宣布完成了examglogeneautotemcel(ex......
4月3日,VertexPharmaceuticals(Nasdaq:VRTX)和CRISPRTherapeutics(Nasdaq:CRSP)宣布完成了examglogeneautotemcel(ex......
CRISPR-Cas系統廣泛存在于細菌、古菌和某些細菌的病毒中(bacteriophage),可以特異性識別并降解外源入侵的基因。根據CRISPR-Cas系統干擾機制的不同,這些系統被分為兩類,即Cl......
CRISPR-Cas系統廣泛存在于細菌、古菌和某些細菌的病毒中(bacteriophage),可以特異性識別并降解外源入侵的基因。根據CRISPR-Cas系統干擾機制的不同,這些系統被分為兩類,即Cl......
CRISPR-Cas系統廣泛存在于細菌、古菌和某些細菌的病毒中(bacteriophage),可以特異性識別并降解外源入侵的基因。根據CRISPR-Cas系統干擾機制的不同,這些系統被分為兩類,即Cl......
1月19日,中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)陳玲玲研究組在GenomeBiology上,發表了題為CRISPR-dCas13-tracingrevealstranscr......
1月19日,中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)陳玲玲研究組在GenomeBiology上,發表了題為CRISPR-dCas13-tracingrevealstranscr......
1月19日,中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)陳玲玲研究組在GenomeBiology上,發表了題為CRISPR-dCas13-tracingrevealstranscr......
1月19日,中國科學院分子細胞科學卓越創新中心(生物化學與細胞生物學研究所)陳玲玲研究組在GenomeBiology上,發表了題為CRISPR-dCas13-tracingrevealstranscr......
CRISPR/Cas9是源自細菌獲得性免疫系統的新一代基因編輯技術,在化學生物學、生物醫學及基因治療中具有潛在應用前景。CRISPR/Cas9技術使用引導RNA(single-guideRNA,sgR......