中藥作為傳統藥物,在中國有著上千年的使用歷史。隨著中藥產品的影響力越來越大,中藥材更是受到國際高度關注。中藥材在不同國家有不同的歸類和習稱,如在美國習稱“草藥”,歐洲習稱“植物藥”而在日本則稱為“漢方藥”等。
圖片源自網絡
中國作為世界上中藥材品種最為豐富,中藥材產品主要輸出國,近幾年來受到國際貿易中綠色、技術等貿易壁壘的影響,中藥產品的出口貿易現狀不容樂觀。究其原因,主要由于中藥材在生產過程中受到大氣、土壤、水質中的有毒有害成分的影響,以及在種植過程中長期過量的施用農藥、化肥等,導致中藥材普遍存在著重金屬、農藥殘留量超標等問題。同時中藥材在存儲過程中,由于貯存、養護方法不當造成黃曲霉素超標。這些都是嚴重影響中藥材質量安全的主要因素,同時也嚴重制約著我國中藥產品走向國際市場的重要原因,直接影響了中藥在國際市場上的競爭力。
本文通過系統的文獻查閱,主要整理完成了中國、中國香港、美國、歐盟、日本、等主流藥典最新版中對于中藥材(植物藥)中的重金屬、農藥殘留、黃曲霉毒素的限量標準,為順應綠色趨勢制定完善的中藥材質量標準提供借鑒,也為中藥產品進入國際市場,提高國際競爭力提供參考。
Part1中國藥典
1、農藥殘留限量標準
農藥殘留是指農藥使用后殘存于中藥材中的農藥原體、有毒代謝物、降解物和雜質的總稱。中藥材農藥殘留種類包括有機氯、有機磷、氨基甲酸酯、擬除蟲菊酯等,這些農藥對人體健康都有極大的危害。國際上從1970年起就開始研究藥用植物的農藥殘留問題,1980年,世界衛生組織將農藥殘留測定單獨列為檢測項目。中國藥典2000版一部首次對中藥材制定了農藥殘留限量標準,其后更是不斷增加品種,完善檢測農藥種類,同國際接軌。
10版藥典只規定了黃芪和甘草的農藥殘留限量標準,并且農藥品種也只有六六六、滴滴涕、五氯硝基苯三個,15版藥典在10版的基礎上新增了人參和西洋參的農藥殘留限量檢查,并豐富了其檢查的農藥殘留品種(黃芪和甘草還是只檢查原來的三種,限值未變)。

2、重金屬限量標準
重金屬通常是指一類密度大于4.5kg·dm-3的金屬或合金物質,常見的對人類健康具有影響的重金屬主要有鉛、汞、鎘、銅、鉻等,還有一種非金屬元素砷,由于在分析重金屬污染時,它經常與重金屬元素一同出現,習慣上將砷歸入重金屬部分進行分析闡述。中藥中重金屬的來源有兩種:一是藥物本身含有重金屬,如朱砂和雄黃等礦物藥及其制劑;二是與產地的生態環境、炮制加工、制備工藝、儲藏等環境有關。國際上很早就對藥用植物重金屬污染問題開始關注,《中國藥典》2000版有重金屬限量要求的僅18種,約占2%(規定中藥注射劑中重金屬含量≤0.15mg/kg,其他藥品中重金屬≤20mg/kg)。為了加強中藥的安全性,《中國藥典》2005年版首次對西洋參、白芍、甘草、丹參、金銀花、黃芪等提出了重金屬分類限量要求。
15版藥典在10版基礎上,涉及重金屬及有害元素限量的新增品種共8個,根據以下表格可以看出,《中國藥典》2015年版重點增加了對水產藥材的重金屬及有害元素進行了限量控制。


3、黃曲霉素限量標準
中藥材及其制劑在貯存過程中常發生霉變現象,產生對人體有害的霉菌毒素,其中黃曲霉毒素是由真菌黃曲霉(Aspergillusflavus) 和寄生曲霉(Aspergillus parasiticus)產生的一類代謝產物,毒性極強,廣泛存在于自然界中。中國藥典2005版增補本中首次收載了黃曲霉毒素的測定方法,但并未對具體品種進行限量規定。
《中國藥典》2010版(包括增補本)規定了僵蠶、陳皮、胖大海、桃仁、酸棗仁5個品種的黃曲霉毒素的限量標準。2015年版在以往藥典的基礎上,新增柏子仁、蓮子、使君子、檳榔、麥芽、肉豆蔻、決明子、遠志、薏苡仁、大棗、地龍、蜈蚣、水蛭、全蝎14味藥材及其飲片。

Part2中國香港
《香港中藥材標準》(以下簡稱“港標”)是衛生署中醫藥事務部主持開展的研究項目。該項目自2002年開始推行,分階段為常用中藥材制訂標準,以確保中藥材的安全及質量。2005年出版了第一冊(包括英文版本、中文版本),涵蓋了8種中藥材,截止2015年,共出版7冊,合計236種中藥材。分中文版和英文版兩個版本。港標除參考了內地藥典已有的資料外,也包含內地藥典中沒有的重要范疇,如對重金屬、農殘、黃曲霉毒素等含量的限制。一批國際中醫藥材界著名專家參與了標準的制定,香港浸會大學和中文大學也承擔科研工作,國家食品藥品監督管理局則協助在內地采收和鑒定藥材的工作。目前的質量標準僅覆蓋了中藥材,對于中藥飲片的質量標準制定還在不斷的摸索中。
港標的藥材來源主要收載現行流通于香港市面的品種。性狀描述以完整干燥藥材為主,對于多來源藥材,如各品種在性狀上沒有顯著分別,則統一描述,如有分別,則對每個品種分別描述。檢查項目包括藥材所含的重金屬、農藥殘留、霉菌毒素(如黃曲霉毒素)、雜質、灰分、水分以及其他需要控制的化學成分。港標的特色是每個專論均給出藥材的橫切面和粉末特征圖。同時每個專論都有高效液相色譜指紋圖譜鑒別,提供詳細的色譜系統和操作程序,并考察系統適用性要求,給出指紋圖譜,并指出特征峰的相對保留時間以及可變范圍。港標內容簡潔、詳細,圖文并茂,操作性強,并提供中英文版本,與國際植物藥標準接軌,是國際化的中藥材標準。
1、農藥殘留限量標準
港標對中藥材農藥殘留品種及限量同中國藥典很接近。然而香港中藥材標準更為嚴格,對所有中藥材品種都規定了農藥殘留限量標準。

2、重金屬限量標準
港標對所有中藥材品種都規定了重金屬限量標準。重金屬種類及限值并沒有15版藥典的嚴格。
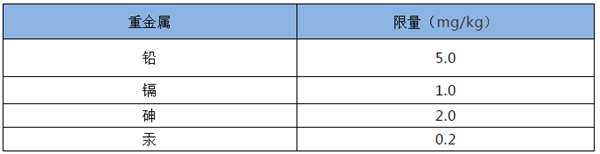
3、黃曲霉毒素限量標準
同樣港標對所有中藥材品種都規定了黃曲霉毒素限量標準,其限值同15版中國藥典相同。

Part3美國藥典
美國藥典-國家處方集(U.S.Pharmacopeia / National Formulary)(USP-NF) 是由美國政府所屬的美國藥典委員會(The United States PharmacopeialConvention)編輯出版的關于藥典標準的公開出版物。USP于1820年發行第一版,自2012年,每年更新一版,該藥典自1980年版起與《國家藥方集》(NF)合并。USP中提供關于原料藥和制劑的質量標準。關于食物補充劑和成份的質量標準在 USP 中以獨立章節予以收載。NF 中提供關于輔料的質量標準。每一版的藥典包括3卷及兩個增補本。《美國藥典》 (現行版USP38-NF 33)是唯一由美國食品藥品監督管理局 (FDA) 強制執行的法定標準,也是目前世界上規模最大的一部藥典。
大部分植物藥目前在美國以膳食補充劑的方式上市和監管。USP發行了專門針對膳食補充劑的質量標準集《USPDietary Supplements Compendium(USP 膳食補充劑法典)》,首先闡明其基源植物學名、藥用部位以及指標成分的限量。具體的記載內容主要有:包裝、貯存和標簽。USP/NF對植物藥的微生物檢查、農藥殘留和重金屬的規定十分明確,多數植物藥品種都有上述3項的規定,這點與其他藥典明顯不同。
1、農藥殘留限量標準
USP37-NF 32規定了70 種農藥殘留的限量,除在各品種項下另有規定外,所有規定藥材都要滿足這70 種農藥殘留限量的規定.。如若有規定之外的殘留,則需滿足美國國家環境保護署(EPA)/歐盟法規(Regulation(EC)No.396/2005)的有關規定,由此見得,美國對草藥中農藥殘留的規定遠遠高于中國藥典。


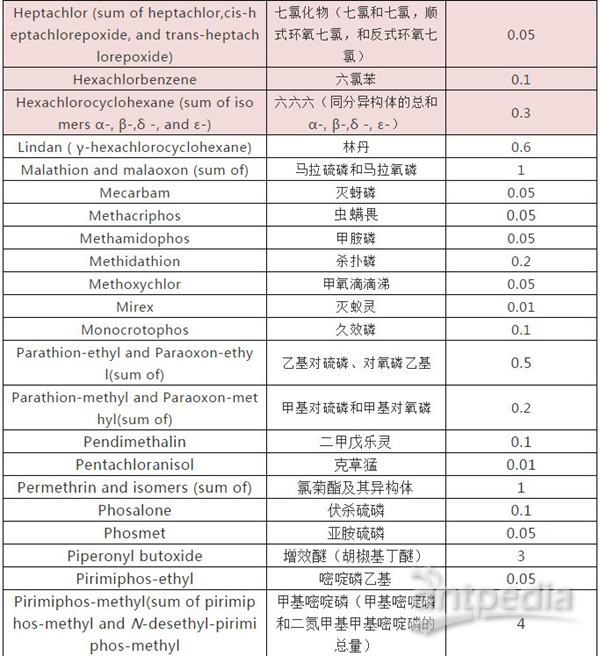

2、重金屬限量標準
除藥典對草藥重金屬的規定外(下表),美國國家衛生基金會(NSF)頒布的膳食補充劑標準(Dietary-Supplements-Standard173)中,分別對膳食補充劑成品和膳食補充劑原料中重金屬殘留做了相關規定。

3、黃曲霉毒素限量標準
USP 37-NF 32對絕大部分草藥品種滿足以下黃曲霉毒素的規定,對部分草藥中黃曲霉毒素含量的限量要求更為嚴格,分別為黃曲霉毒素B1含量不大于2. 0 μg·kg-1,B1、B2、G1、G2總量不超過4. 0 μg·kg-1。

Part4歐洲藥典
《歐洲藥典》由歐洲藥品質量管理局(EDQM)負責出版和發行,是歐洲藥品質量控制的標準,成員國(目前37個)的國家當局必須采用歐洲藥典。1977年出版第一版《歐洲藥典》。自2011年起,基本每3年更新一版。目前最新為第八版,于2014年1月生效。歐洲藥典第8版包括兩個基本卷,于2013年7月出版發行,以后在每次歐洲藥典委員會全會做出決定后,通過非累積增補本更新,每年發行3個增補本。第8版累計共有8個非累積增補本(8.1~8.8)。最初的兩卷包括第7版完整的內容,以及歐洲藥典委員會會議通過或修訂的內容。第8版《歐洲藥典》總共收錄近300個植物藥專論。《歐洲藥典》對植物藥的記載內容主要包括定義、鑒別、檢查、含量測定。其中定義包括規定指標成分的含量。其質量檢測十分注重指標性成分含量、有無放射性及農藥、重金屬、污染物等的殘留量。歐洲藥典有英文版與法文版,英語與法語是歐洲委員會的官方語言。
1、農藥殘留限量標準
歐洲藥典中植物藥的農藥殘留限量標準同美國藥典(如上表所述)。除非專論中有特殊的注明,歐洲藥典里的植物藥至少應該符合上表中農殘限量要求。對于懷疑存在又未在上表中列出的的農藥殘留,則需遵守歐盟農藥最大殘留限量法規396/2005號條例。
2、重金屬限量標準
除非在植物藥各論中有明確說明或者其他規定,植物藥重金屬限量標準需滿足以下條件。

3、黃曲霉毒素限量標準
除非在各論中特別注明,歐洲藥典規定植物藥中黃曲霉素毒素需滿足以下要求。相比之下,歐洲藥典對黃曲霉毒素的要求較為嚴格,成為目前世界上最為嚴格的黃曲霉毒素限量規定。

Part5 日本藥典
日本藥典又名日本藥局方(The Japanese Pharmacopoeia)由日本藥局方編輯委員會編篡,由厚生省頒布執行。分兩部出版,第一部收載原料藥及其基礎制劑,第二部主要收載生藥,家庭藥制劑和制劑原料。1886年6月25號頒布第一版,1887年7月1日開始實施。每5年更新一版,期間會有兩個增補版本。目前最新版為2011年出版的第十六版(即JP16)。該版局方僅收載生藥品種276條,包括藥材、飲片及成方制劑。按五十音圖排序,藥材與成方制劑混排。其中藥材161條,粉末飲片55條,提取物與成方制劑60條。與《中華人民共和國藥典》2010版一部相同藥材品種136條,成方制劑中傳統漢方藥22條。《日本藥局方》對生藥的記載內容包括基源植物學名、性狀、顯微特征、鑒別、指標成分含量限度、純度檢查、干燥失重、總灰分、酸不溶性灰分、浸出物含量等。
1、農藥殘留限量標準
日本藥局方第16版中收載了黃芪、遠志(遠志末)、甘草(甘草末)、桂皮(桂皮末)紅參、細辛、山茱萸、番瀉葉(番瀉葉末)、紫蘇葉、大棗、陳皮、人參(人參末)、枇杷葉、牡丹皮(牡丹皮末)14個生藥品種。而對這些生藥的農藥殘留也只是規定了BHC和DDT的限量標準。

2、重金屬限量標準
日本藥局方規定了郁金(郁金末)、烏藥、延胡索(延胡索末)、黃芪、黃芩(黃芩末)、黃精、遠志(遠志末)、何首烏、莪術、葛根、滑石、吉草根(吉草根末)、栝樓根等約110個生藥品種的重金屬限量標準,絕大部分依下表要求。雖然規定的生藥品種較多,然而重金屬的種類僅涉及到了鉛和砷。

結 論
本文通過對中國藥典(10版、15版)與美國藥典(USP37-NF32)、歐盟藥典(EP8.0)日本藥典(JP16)以及香港地區中藥材標準中中藥材(植物藥)農藥殘留、重金屬、黃曲霉毒素的標準限量闡述及對比分析,可得中國藥典對于有毒有害殘留的限值要求基本已達到國際標準,但是規定的有毒有害殘留種類較少,所涉及的中藥材品種也較其他國家藥典有很大的差別。中藥產品國際化的阻力之一就是中藥材的質量與注冊要求與國際標準相比存在很大差距。想要使中藥走向國際化首先要嚴格控制原料藥材的安全性和有效性,為此國家、企業應大力推廣中藥材規范化種植(GAP),嚴把中藥材種植質量關;提高綠色環保意識,順應歷史潮流,積極開發綠色產品;提高藥典質量控制水平,完善中藥材質量標準,使其符合國際標準。只有中藥材的安全性、有效性得到世界范圍的認可,中藥產品國際化才有可能實現。
1月2日,國家藥典委員會在其官方網站發布了新修訂的《國家藥用輔料標準編寫細則(2025年版)》。此舉是為了進一步提高中國藥典中藥用輔料標準的科學性和規范性,確保公眾用藥安全有效。本次修訂是在《國家藥用......
為促進首臺(套)重大技術裝備創新發展和推廣應用,根據天津市重大技術裝備的發展現狀,在廣泛征求相關重點企業意見基礎上,經組織行業知名專家評審論證,天津市工業和信息化局制定了《天津市首臺(套)重大技術裝備......
2024年11月27日,第十二屆藥典委員會執行委員會全體會議在京舉行,審議通過2025年版《中華人民共和國藥典(草案)》,部署推進新版藥典頒布實施工作。國家藥監局黨組書記、局長、第十二屆藥典委員會主任......
2024年11月18日,實驗室行業的璀璨盛會——慕尼黑上海分析生化展(analyticaChina)和上海實驗室規劃建設與管理大會(labtechChinaCongress)在新國際博覽中心盛大揭幕。......
近期,重慶市藥監局組織對太極集團重慶涪陵制藥廠有限公司建于石柱縣的紫蘇葉種植基地進行了中藥材生產質量管理規范(GAP)延伸檢查,經綜合評定,認為該基地符合要求,并于日前發布重慶市首批中藥材GAP延伸檢......
為進一步貫徹落實《中共中央國務院關于促進中醫藥傳承創新發展的意見》中“支持珍稀瀕危中藥材替代品的研究和開發利用”的有關部署,加強珍稀瀕危野生藥用動植物資源保護,支持珍稀瀕危中藥材野生撫育、人工繁育和替......
2024年12月12-13日“第七屆中國武漢光谷生物學術年會暨生物制藥質量分析技術論壇”聚焦新型疫苗質量工藝開發,蛋白/納米抗體ADC質量與工藝,核酸藥物領域的最新動態、生產工藝變革等內容,實現深度交......
會議簡介為推動我國分析科學與儀器領域自主創新和高質量發展,加強產學研用協作,促進分析科學基礎研究和儀器研發,提升人才培養和企業發展的水平,中國分析測試協會決定于2024年11月8-12日在成都召開“首......
2024年8月8日,第十八屆全國青年分析測試學術報告會于廣西壯族自治區桂林市成功舉辦。本次大會由中國分析測試協會主辦,得到廣西師范大學省部共建藥用資源化學與藥物分子工程國家重點實驗室、化學與藥學學院、......
最近,甘肅省隴西縣“新農人”王斌忙得不亦樂乎。這兩天,他最新研制生產的一款黃芪咖啡飲品剛剛下線,這是他依托家鄉隴西豐厚的中藥材家底,研制出的第1001款中醫藥保健產品。位于隴中黃金地帶的隴西縣,素有“......