目前沒有藥物可用于治療埃博拉病毒、登革熱病毒或寨卡病毒,這些病毒每年感染數百萬人并導致嚴重疾病、先天性缺陷,甚至死亡。如今,來自美國格拉德斯通研究所和加州大學舊金山分校的兩項新研究最終可能改變這一點。他們鑒定出這三種病毒劫持人類細胞的關鍵途徑,并且發現至少有一種潛在的藥物能夠破壞人類細胞中的這個劫持過程。更重要的是,他們發現寨卡病毒如何可能導致嬰兒出現小頭畸形(microcephaly),這是開發一種阻止這種疾病的方法的第一步。這兩項新的研究以背靠背的形式發表在2018年12月13日的Cell期刊上,論文標題分別為“Protein Interaction Mapping Identifies RBBP6 as a Negative Regulator of Ebola Virus Replication”和“Comparative Flavivirus-Host Protein Interaction Mapping Reveals Mechanisms of Dengue and Zika Virus Pathogenesis”。格拉德斯通研究所高級研究員、加州大學舊金山分校定量生物科學研究所主任Nevan Krogan博士是這兩篇論文的通訊作者。
圖片來自Cell, doi:10.1016/j.cell.2018.08.044。
在這兩篇論文中,這些研究人員采用了一種稱為蛋白-蛋白相互作用圖譜(protein-protein interaction mapping)的技術來研究這三種病毒。該方法使用實驗室培養皿中的人細胞來構建病毒和人類蛋白之間的每個接觸點的圖譜。他們如今正在利用這些綜合圖譜來靶向這些相互作用并試圖清除病毒感染。
Krogan說,“我們在埃博拉病毒、登革熱病毒和寨卡病毒中采用了我們的系統性蛋白-蛋白相互作用策略,以便更好地了解這三種非常有問題的病毒如何劫持和感染人類細胞。對我來說,最令人關注的是我們觀察到人體中的相同蛋白被看似非常不同的病毒和不同的致病蛋白劫持。”
通過將一種病毒的蛋白-蛋白相互作用圖譜與另一種病毒的蛋白-蛋白相互作用圖譜進行比較,這些研究人員能夠發現被幾種不同的病毒靶向的人類蛋白,而且這些蛋白也可能參與其他類型的人類疾病。
這意味著靶向這些人類蛋白---可能被認為是人類的弱點---可能有效地治療許多不同的疾病。比如,Krogan和他的團隊發現,一種最初作為抗癌藥物加以研究的候選藥物能夠成功地清除登革熱病毒和寨卡病毒在人細胞中引起的感染。
增強身體抵抗埃博拉病毒的防御
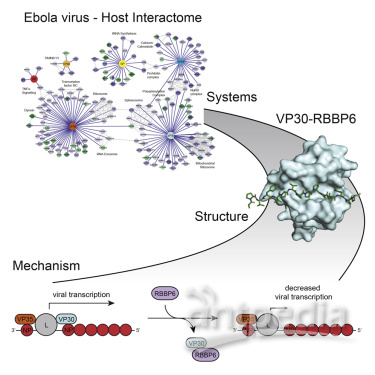
在第一篇論文中,Krogan團隊通過與美國佐治亞州立大學的Christopher Basler博士合作鑒定出194種涉及6種埃博拉病毒蛋白的病毒-人類相互作用。他們將他們的關注點縮小到埃博拉病毒蛋白VP30與人類蛋白RBBP6之間的一個特定的接觸點上。
這種相互作用首先引起了他們的注意,這種因為它是非常強大的,但是RBBP6最終成為一種特別令人關注的蛋白的原因在于它也出現在其他的病毒-蛋白相互作用圖譜中,這導致Krogan相信它在免疫系統中起著重要作用。
事實證實RBBP6模仿另一種稱為NP的埃博拉病毒蛋白。VP30和NP需要彼此結合在一起才能讓埃博拉病毒復制。然而,人類蛋白RBBP6通過附著到VP30上來中斷這個過程。因此,通過阻斷這兩種埃博拉病毒蛋白之間的結合,RBBP6有效地阻止這種病毒復制。
令人吃驚的是,這些研究人員沒有發現埃博拉病毒攻擊宿主(在第一篇論文中指的是人類細胞)。相反,他們發現了一種讓宿主抵御這種病毒的方法。
第一篇論文的共同第一作者、格拉德斯通研究所博士后研究員Jyoti Batra博士(之前在Basler實驗室工作過)說,“我們經常發現病毒蛋白經進化后模擬人類蛋白,但是在這篇論文中,情況剛好相反。這看起來我們的身體天然就能夠抵抗埃博拉病毒感染,而且這種病毒尚未克服這一點。請記住,我們仍然沒有很好的機制來抵抗埃博拉病毒,但是如果缺乏這種保護,那么這種病毒就會變得更加致命。”
為了驗證這一理論,Batra與第一篇論文的另一名共同第一作者Judd Hultquist博士合作開展研究。他們一起對人類細胞進行基因改造,使得它們不含有蛋白RBBP6或者含有比正常水平高得多的RBBP6。隨后,他們利用埃博拉病毒感染這些細胞。在缺乏這種保護性蛋白的人類細胞中,感染率上升了5倍。然而,具有更高水平的RBBP6的人類細胞強烈地阻止這種病毒感染。
Krogan團隊如今正在尋找能夠模擬RBBP6抵抗埃博拉病毒感染作用的藥物。Krogan,“這是一種關鍵的相互作用。問題在于我們是否能夠以一種有效的藥理學方式對它進行操縱,以便讓它具有治療價值。”
擊敗登革熱病毒和寨卡病毒
在第二篇論文中,Krogan實驗室與來自美國西奈山伊坎醫學院和貝勒醫學院的研究人員合作。他們探究了存在親緣關系的登革熱病毒和寨卡病毒,這兩種病毒都是由蚊子傳播并引起類似的臨床癥狀。
這些研究人員猜測如果這兩種病毒以相似的方式與人類蛋白相互作用,那么靶向這些蛋白相互作用可能是抵抗這些感染的最佳方法。他們還繪制了登革熱病毒和蚊子蛋白之間的相互作用圖譜,并將它與人類-病毒蛋白圖譜進行比較。
作為第二篇論文的第一作者,美國加州大學戴維斯分校化學工程、微生物學與分子遺傳學助理教授Priya Shah博士說,“非常有趣的是,一種病毒能在兩種有機體---人類和蚊子---中做同樣的事情,要知道這兩種有機體在數億年的進化過程中早已分化開來。這種病毒在人類和蚊子細胞中基本上以相同的方式進行復制。因此,如果我們能夠靶向被這種病毒利用的這些細胞的共同部分,我們就可能鑒定出一種潛在的強大治療靶標。”
通過比較這三種蛋白相互作用圖譜,這些研究人員鑒定出一種在這兩種病毒和兩種宿主物種中發生的相互作用:病毒蛋白NS4A和宿主蛋白SEC61。眾所周知,SEC61在某些形式的癌癥中起著至關重要的作用,而且Krogan在加州大學舊金山分校的同事Jack Taunton博士之前已開發出靶向這些蛋白的化合物作為潛在的抗癌藥物。當將這些化合物添加到人類細胞和蚊子細胞中時,它們有效地清除了登革熱病毒感染和寨卡病毒感染。
Taunton說,“我們已開發出一種早期的化合物,它在人類細胞和蚊子細胞中具有非常強的抵抗登革熱病毒和寨卡病毒的活性。如今,我們需要調整這種分子,以便在患者中進行測試之前,優化它的安全性和有效性。”
Krogan說,“這是一個將最初為治療一種疾病而開發的化合物改用到治療另一種疾病的例子。 一種更大的情形是通過查找這些數據集和疾病,我們能夠找到新的關聯和新的解決方案。”
理解寨卡病毒如何導致小頭畸形
盡管登革熱病毒和寨卡病毒是非常相似的,但是僅寨卡病毒能夠導致破壞性的出生缺陷:小頭畸形。因此,在最后一組實驗中,Krogan團隊尋找了寨卡病毒蛋白與人類蛋白相互作用而登革熱病毒蛋白不與人類蛋白相互作用的例子。
特別突出的一個相互作用是在寨卡病毒蛋白NS4A和人類蛋白ANKLE2之間的相互作用,其中ANKLE2對大腦發育非常重要。在此之前,人們已發現ANKLE2發生的突變與遺傳性小頭畸形有關。
這些研究人員發現寨卡病毒蛋白NS4A似乎抑制ANKLE2的功能,最終損害大腦發育并導致小頭畸形。他們計劃利用這些知識開始開發靶向ANKLE2的方法以便阻止與寨卡病毒相關的小頭畸形。
尋找重疊蛋白
這兩項研究已讓這些研究人員有希望開發出靶向埃博拉病毒、登革熱病毒和寨卡病毒的新療法,或者改變現有療法的用途。通過靶向這兩項研究中鑒定出的蛋白相互作用---特別是人類蛋白RBBP6和SEC61,這些研究人員能夠根除人類細胞中的所有這三種病毒,這是開發針對這些疾病的潛在療法的重要開端。
這些研究將繼續在加州大學舊金山分校的宿主病原體圖譜計劃(Host Pathogen Mapping Initiative)和格拉德斯通研究所的BioFulcrum病毒與傳染病研究計劃(BioFulcrum Viral and Infectious Disease Research Program)下繼續開展。加州大學舊金山分校的宿主病原體圖譜計劃近期獲得美國國家衛生研究院800萬美元的資助,重點關注結核桿菌和葡萄球菌。這兩種影響深遠的研究計劃已產生HIV、結核桿菌、丙型肝炎病毒、皰疹病毒、人乳頭瘤病毒和衣原體的蛋白-蛋白相互作用圖譜。
Krogan說,“我們開始發現不同病毒劫持的蛋白之間存在重疊。不僅如此,這些相同的蛋白經常在具有遺傳根源的疾病(比如癌癥和自閉癥)中發生突變。我們在看似無關的疾病之間找到更多的共性,我們就能夠更好地確定治療這些破壞性疾病的療法。”
9月12日,中國科學院微生物研究所施一、齊建勛、高福院士團隊,在《自然》(Nature)上,發表了題為MolecularmechanismofdenovoreplicationbytheEbolavi......
《自然·氣候變化》最新發表建模研究顯示,能阻斷登革熱病毒等蚊媒病毒傳播的沃爾巴克氏體細菌的wMel菌株,在到2030年代的預測熱浪情景下可能依然有效。不過,其在更長期變暖情景下的效果還不確定。包括瘧疾......
近日,中國農業科學院哈爾濱獸醫研究所與國外高校合作,闡明了內質網分子伴侶通過內質網膜上的E3泛素連接酶RNF185調控埃博拉病毒囊膜糖蛋白合成的新機制,該研究成果發表在《自然通訊(NatureComm......
寨卡病毒是一種主要由媒介伊蚊(埃及伊蚊和白紋伊蚊等)傳播的黃病毒。近日,南方醫科大學教授陳曉光團隊研究發現寨卡病毒而非登革病毒-2可以通過血餐和人工尿液感染騷擾阿蚊,被感染的蚊子可以通過叮咬將寨卡病毒......
蚊媒病毒是以蚊蟲作為傳播媒介的病毒的統稱,其中寨卡病毒、登革病毒在內的多種病毒對全球公共衛生造成嚴重威脅。清華大學的研究團隊首次揭示蚊蟲傾向于叮咬病毒感染者從而造成疫病加速傳播的機制,相關成果在《Ce......
埃博拉病毒(Ebolavirus),1976年在扎伊爾和蘇丹首次發現,會引起人體大量內出血,造成病人休克甚至死亡。埃博拉病毒是一種屬于絲狀病毒家族的RNA病毒病原體,導致人類嚴重疾病的爆發。這種公共衛......
寨卡病毒是一類蚊媒傳播病原,感染孕婦可引起新生兒小頭畸形。2015-16年寨卡疫情成為國際公共衛生緊急事件,目前尚無獲批疫苗。寨卡病毒與登革病毒的抗原性接近,屬一個超血清家族。最新的人群隊列研究發現,......
得克薩斯大學加爾維斯頓分校的醫學研究人員首次表明,對懷孕的小鼠進行單次更高劑量的疫苗接種可以安全地保護她和她的胎兒免受寨卡病毒的感染。相關結果發表在《naturecommunications》雜志上。......
得克薩斯大學加爾維斯頓分校的醫學研究人員首次表明,對懷孕的小鼠進行單次更高劑量的疫苗接種可以安全地保護她和她的胎兒免受寨卡病毒的感染。相關結果發表在《naturecommunications》雜志上。......
登革熱病毒(DENV)屬于黃病毒,是單鏈RNA病毒。目前已分離出4個血清型DENV病毒,均具有致病性。伊蚊是其主要宿主,患者和隱性感染者是主要傳染源。患者在發病1日至3日內傳染性最強。目前,還沒有抗病......