今日,羅氏(Roche)和Sarepta Therapeutics公司共同宣布,雙方達成許可授權協議,羅氏將獲得治療杜氏肌營養不良癥(DMD)的基因療法SRP-9001在美國以外地區的獨家推廣權益。Sarepta將總計獲得11.5億美元前期付款(包括7.5億美元現金和4億美元股權投資)和潛在17億美元的里程碑付款。根據Vantage的報道,這是迄今為止,細胞和基因療法領域針對一個在研項目的最大授權許可。
Sarepta公司近日可謂捷報頻傳,日前,美國FDA宣布批準其治療DMD的外顯子跳躍療法Vyondys 53上市,這一批準大幅度提高了該公司第三款在研外顯子跳躍療法casimersen的獲批幾率。而Sarepta公司研發管線中的基因療法雖然曝光度不如幾款外顯子跳躍療法,但是它們在治療DMD患者方面,可能具有更大的潛力。
SRP-9001:針對所有DMD患者的潛在治愈性療法
在DMD患者中,由于編碼抗肌萎縮蛋白(dystrophin)的基因出現突變,導致抗肌萎縮蛋白的缺失或缺陷。肌萎縮蛋白在肌肉收縮時對維持組織的完整性具有重要作用,肌萎縮蛋白的缺陷導致肌肉在收縮過程中出現慢性損傷和炎癥,影響肌肉的再生。最終,肌肉被瘢痕組織或者脂肪取代。DMD患者的肌無力癥狀在2-3歲時就很明顯,隨著肌肉組織和功能的不斷丟失,在12歲時通常只能靠輪椅行動,20歲時需要輔助呼吸,在30-40歲時因為呼吸或心力衰竭而早夭。
目前,Sarepta公司雖然有兩款外顯子跳躍療法獲得FDA的批準,但是它們的局限性在于只能對抗肌萎縮蛋白基因特定區域上出現突變的DMD患者有用,所以獲批的Exondys 51只能治療大約14%的DMD患者,而Vyondys 53只能治療8%的DMD患者。基因療法的優勢在于,無論患者的基因突變出現在抗肌萎縮蛋白基因的哪個地方,它都有潛力給他們帶來療效。
基因療法將表達正常功能抗肌萎縮蛋白的轉基因裝在腺相關病毒(AAV)載體中,然后將這些病毒注入到患者體內。它們能夠將表達抗肌萎縮蛋白的基因導入患者的肌肉細胞中,讓它們成為生成抗肌萎縮蛋白的“體內工廠”。由于編碼抗肌萎縮蛋白的DMD基因是人類基因組中最大的基因之一,而遞送基因療法的AAV病毒載體能夠容納的基因長度有限,因此,目前裝載進入AAV載體的DMD轉基因表達的是稱為“微抗肌萎縮蛋白”的簡化版抗肌萎縮蛋白。
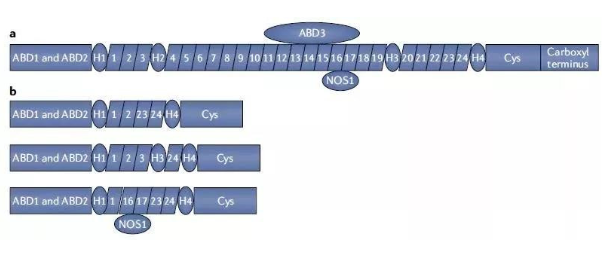
全長抗肌萎縮蛋白(a)和基因療法表達的幾種微抗肌萎縮蛋白(b)
Sarepta公司的SRP-9001是一款使用從非人靈長類動物中分離的AAVrh74載體的基因療法。這一AAV載體的優勢是能夠在肌肉中引起轉基因的強力表達,不會穿過血腦屏障進入中樞神經系統。而且,較少患者體內存在針對這一病毒載體的免疫力。SRP-9001基因療法由MHCK7啟動子驅動轉基因的表達。這款啟動子不但能夠在骨骼肌、心肌和膈肌中驅動轉基因表達,而且尤其增強了轉基因在心臟中的表達。
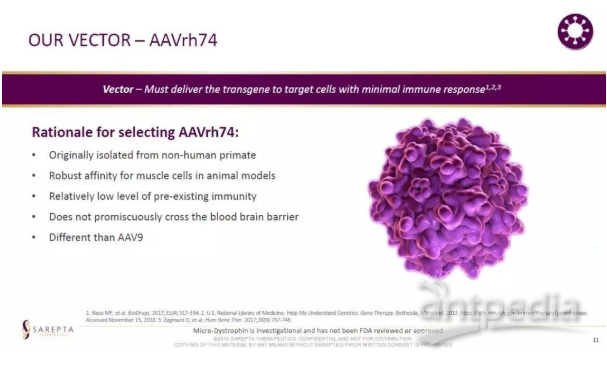
AAVrh74病毒載體
去年公布的早期臨床試驗數據表明,在最初接受治療的4名DMD患者中,SRP-9001基因療法不但表現出良好的安全性,而且在所有患者中都能夠驅動微抗肌萎縮蛋白的表達,其平均值達到正常水平的74.3%。與之相比,近日獲批的Vyondys 53療法只將抗肌萎縮蛋白水平提高到正常值的1%。雖然兩者表達的蛋白類型不一樣(Vyondys 53療法表達的蛋白更接近功能完整的全長抗肌萎縮蛋白),但是SRP-9001能夠驅動高水平的抗肌萎縮蛋白無疑是一個好兆頭。而且,初步試驗結果表明,所有患者的的運動功能評分與基線相比也顯示出了明顯的功能性改善。目前,SRP-9001正在1/2期臨床試驗中接受檢驗。
羅氏11.5億前期付款收獲SRP-9001傳遞了哪些信息?
羅氏與Sarepta的授權許可創下了單項基因療法資產授權許可的紀錄。這一重磅交易的背后又傳達了什么樣的信息?
對AAVrh74病毒載體安全性的信心
使用基因療法治療DMD需要克服的關鍵性挑戰之一是療法的安全性。上世紀末,火熱的基因療法領域一度陷入了近10年的停滯就是因為基因療法引發的免疫反應導致受試患者的去世。而治療DMD患者需要向他們的全身注入大劑量的病毒載體,安全性變得格外重要。可喜的是,近年來隨著AAV載體技術的發展,基因療法的安全性正在得到逐步的提高。今年諾華(Novartis)公司的基因療法Zolgensma獲批治療脊髓性肌萎縮癥(SMA)也是基于AAV載體的基因療法安全性的有力證明。Sarepta公司的AAVrh74載體與在常用的AAV9載體相比,可能在安全性上更具優勢。
抗肌萎縮蛋白水平作為治療DMD的替代終點得到FDA的認可
FDA在加速批準Exondys 51和Vyondys 53時,都認可了肌肉表達的抗肌萎縮蛋白水平作為合理預測患者運動功能改善的指標。這一決定也為DMD基因療法的開發增添了信心。以抗肌萎縮蛋白水平作為替代終點,能夠加快產品開發的步伐,讓創新療法更早獲批,并且交到患者手中。
大型藥企對基因療法青睞不減
今年,不但有兩款基因療法分別獲得美國FDA和歐盟的批準,而且多家大型藥企通過收購具有基因療法專長的生物技術公司在研發管線中納入這一技術平臺。日前,羅氏剛剛完成對基因療法明星公司Spark Therapeutics數額為48億美元的收購。而近日,安斯泰來(Astellas)公司宣布斥資30億美元,收購基因療法公司Audentes Therapeutics。今年早些時候,渤健(Biogen)完成了對基因療法公司Nightstar Therapeutics的收購。根據Vantage的統計,今年收購基因療法產品的金額已經達到170億美元。
而羅氏的最新授權合作表明,大型醫藥公司對基因療法資產的興趣依然不減。除了收購具有基因療法特長的公司以外,已經將基因療法技術平臺納入研發管線的大公司可能轉向添加前景看好的在研項目。
包括DMD在內的很多罕見病是由于在編碼特定蛋白的基因上出現突變而導致的,這讓改變基因表達的基因療法在治療這些疾病方面具有得天獨厚的優勢。我們期待羅氏的投入能夠讓治療DMD的基因療法更快送到患者手中,也期待這一創新治療模式在治療其它疾病時綻放出它的光芒。
羅氏公司7月29日宣布,在獲得所有必要的反壟斷和監管許可后,完成了對LumiraDx公司POCT技術的收購。現在,羅氏將著手將該公司的POCT平臺以及相關的研發、運營和商業機構全面整合到羅氏全球組織中......
2024年7月9日,uniQure宣布其通過大腦直接注射的在研基因療法AMT-130在治療亨廷頓病(HD)的1/2期臨床試驗中獲得積極中期結果。分析顯示,在24個月時,接受高劑量AMT-130治療HD......
·Intellia在新聞稿中稱,這是顯示體內CRISPR/Cas9基因編輯療法可有效重復給藥的首個臨床數據,表明體內基因編輯重復給藥完成概念驗證。NTLA-2001并無針對轉甲狀腺素蛋白淀粉樣變性的重......
6月18日,AscidianTherapeutics宣布與羅氏(Roche)達成一項總額高達約18億美元的研究合作與許可協議,將共同發現和開發針對神經系統疾病的RNA外顯子編輯療法。根據協議,Asci......
Roche羅氏近日公布財報,2023年實現營業收入587.16億瑞士法郎,固定匯率下同比增長1%(CER,下同),2023年公司歸母凈利潤1......
根據公開信息,這是我國完成的首例針對罕見病的慢病毒基因療法I期臨床患者給藥,也是上海首次牽頭開展的地中海貧血基因治療臨床試驗,標志著BD211基因療法在攻克地中海貧血這一全球性遺傳性疾病道路上邁出了堅......
科技日報訊 (記者張夢然)一名完全失聰的英國女孩成為世界上首個接受開創性新基因治療試驗的人。目前,她的聽力已得到了恢復。該成果在近期于美國巴爾的摩舉行的美國基因與細胞治療學會會議上被公布。歐......
《自然·通訊》雜志14日發表了一項研究,來自澳大利亞西梅德兒童醫學研究所(CMRI)的研究團隊在整個人類肝臟中測試了一種基因療法,目的是為危及生命的遺傳病開發更有效的治療方法。研究人員表示,這是首次直......
《自然·通訊》雜志14日發表了一項研究,來自澳大利亞西梅德兒童醫學研究所(CMRI)的研究團隊在整個人類肝臟中測試了一種基因療法,目的是為危及生命的遺傳病開發更有效的治療方法。研究人員表示,這是首次直......
羅氏近期公布了2023年財報,盡管COVID-19銷售大幅下降,羅氏超過指引,實現2023年1%的銷售增長(CER) ●集團銷售以恒定匯率(CER)增長1%1(在瑞士法郎下降7%),完全抵消......