上一期為大家介紹了過去一年里CRISPR技術在動物造模及單堿基技術方面取得的重大突破。本期繼續為大家從功能基因組篩選、細胞譜系示蹤及疾病診斷方面談談CRISPR-Cas系統的技術運用。
一、大規模基因功能的篩選
盡管測序和基因組編輯技術取得了重大進展,但是解析復雜的基因型-表型關系仍然是數量遺傳學的一個主要障礙。作為強大的基因編輯工具,CRISPR-Cas9系統能夠在蛋白編碼基因的外顯子區域產生移碼突變而徹底破壞蛋白表達及功能,這一特性被廣泛應用于基因的大規模功能性篩選研究,這也將大大加速評估基因變異的功能影響。
1. 利用CRISPRa構建無偏向性的耐藥相關LncRNA篩選平臺
2018年4月Cell期刊上刊登一項研究開發了一種開創性的方法來鑒定和確定在急性髓細胞白血病(AML)中lncRNA在化療藥物產生耐藥性中所起的功能作用。這一技術通過結合公開可獲得的藥理學數據庫的信息與CRISPR技術,篩選影響治療反應的編碼基因和非編碼基因。作為一種全基因組篩查平臺,既不偏向于編碼基因,也不偏向于非編碼基因,能夠篩選到新的治療靶標[1]。

2. 利用一一配對的靶點-模板策略實現全基因組高效精準突變
理解DNA突變體的功能效應對于基礎生物學、進化生物學和醫學遺傳學的研究至關重要;盡管CRISPR-Cas9技術可以實現體內數以千計細胞發生多基因誘導突變的可能,然而高通量測序這些突變體的特異性仍然是技術的瓶頸。2018年4月Nat
Genet期刊刊登了一篇研究,通過改造CRISPR-Cas9系統,解決了目前高通量測序數以萬計基因組編輯結果的這一壁壘,開發了一種基于CRISPR的全基因組高效精確突變工程的方法。如圖所示,通過構建10000對編碼gRNA靶向序列及其相應的順式修復模板的質粒文庫來實現靶點和模板的一一配對,將文庫遞送到酵母細胞中監測基因突變的影響,突變效率高達95
%。這一策略可以高效精確地追蹤大量基因突變對細胞功能的影響,為研究基因的功能提供了強有力的分析工具[2]。

3. Guide+donor:利用CRISPR-Cas9在酵母中高通量構建和功能分析DNA序列變異文庫
2018年5月,哈佛基因編輯大牛Church研究組在Nature Biotechnology發文,介紹了一種基于Cas9的方法,在酵母中高效(80-100%)產生特定遺傳變異(缺失、替換和插入)的突變體文庫,以及整體跟蹤其適應性的方法。使用guide+donor方法精確地剔除了酵母基因組中的315個基因,并評估和鑒定了對細胞適應性存活中起重要作用的基因。新的方法不僅能以高通量的方式在酵母菌中精確地進行功能基因組研究,還能深入挖掘低頻基因突變及非編碼序列的基因功能,為基因功能分析打開了新的大門[3]。

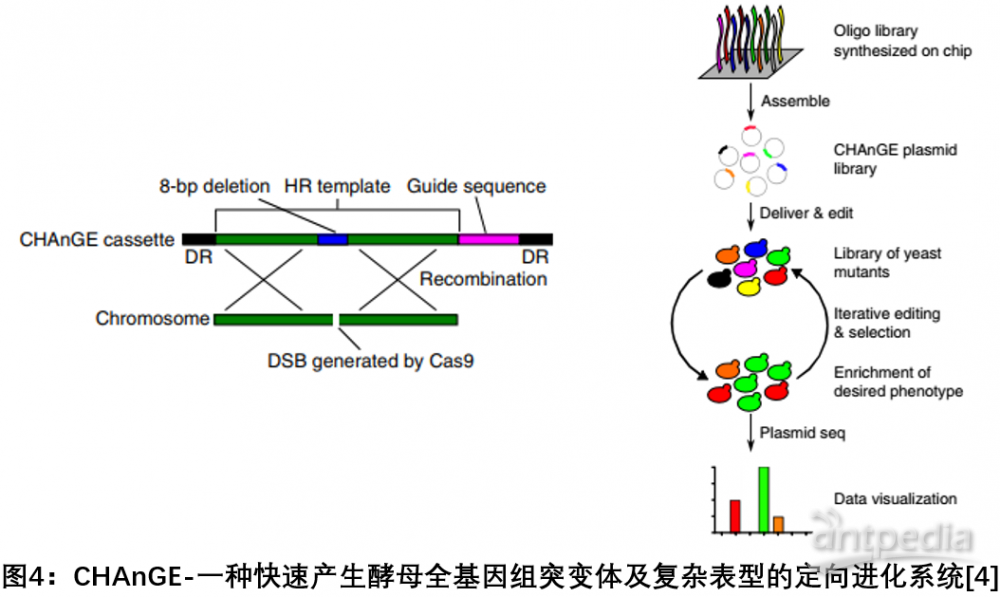
4. CHAnGE:一種基于CRISPR-Cas9和同源定向修復相關的大規模基因組篩選方法
2018年7月,美國伊利諾伊大學趙惠民研究組在Nature Biotechnology發文,開發了一種基于CRISPR - Cas9和同源定向修復相關的大規模基因組篩選方法CHAnGE,可以在全基因組范圍快速產生成千上萬種精確的酵母單核苷酸突變體,追蹤基因突變對細胞的影響,突變效率超過98 %。該研究通過創建全基因組基因突變集合驗證了該方法對單核苷酸分辨率基因組編輯的可行性,解決了之前的方法編輯效率局限性的問題。該方法能夠對釀酒酵母進行全基因組規模的快速工程化,并進行精確和可追蹤的基因突變[4]。
5. MAGESTIC:一種在酵母中可追蹤基因組條形碼的多重精確基因組編輯技術
2018年7月,美國斯坦福大學的 Steinmetz LM課題組在Nature Biotechnology發文,開發了一種基于Cas9技術利用短的、可追蹤的整合性細胞條形碼(MAGESTIC)在釀酒酵母中進行多重精確基因組編輯的方法。MAGESTIC使用合成的陣列gRNA-donor的寡核苷酸的質粒系統進行高通量編輯,具有基因組條形碼整合的功能,可以防止質粒條形碼的丟失,維持穩定的表型。利用LexA - FKH1P融合系統將供體DNA主動招募到DNA斷裂部位的方法,可以提高同源重組的效率。并且相比donor融合到Cas9的方式具有更大的優勢,一方面可以招募更多拷貝的donor,同時還不依賴于Cas9與DSBs的持續關聯。這一技術克服了目前可行方法的幾個限制,即質粒條形碼的不穩定性,以及在表型分析期間無法區分靶向RNA和供體模板中的Oligo合成和PCR或測序引起的錯誤。MAGESTIC技術將廣泛用于揭示酵母表型的遺傳基礎[5]。