3. 實驗過程
通過分子生物學克隆技術, 應用單克隆細胞技術的篩選,將熒光素酶的基因穩定整合到預期觀察的細胞的染色體內,培養出能穩定表達熒光素酶蛋白的細胞株。
典型的成像過程是:小鼠經過麻醉系統被麻醉后放入成像暗箱平臺,軟件控制平臺的升降到一個合適的視野,自動開啟照明燈拍攝第一次背景圖。下一步,自動關閉照明燈,
在沒有外界光源的條件下拍攝由小鼠體內發出的光,即為生物發光成像。
與第一次的背景圖疊加后可以清楚的顯示動物體內光源的位置,完成成像操作。之后,軟件完成圖像分析過程。使用者可以方便的選取感興趣的區域進行測量和數據處理及保存工作。當選定需要測量的區域后,軟件可以計算出此區域發出的光子數,獲得實驗數據。軟件的數據處理和保存功能非常強大,可以加快實驗速度,方便大批量的實驗。
4.熒光成像功能
熒光發光是通過激發光激發熒光基團到達高能量狀態,而后產生發射光。常用的有綠色熒光蛋白(GFP)、紅色熒光蛋白DsRed
及其它熒光報告基團,標記方法與體外熒光成像相似。熒光成像具有費用低廉和操作簡單等優點。
同生物發光在動物體內的穿透性相似,紅光的穿透性在體內比藍綠光的穿透性要好得多,近紅外熒光為觀測生理指標的最佳選擇。
雖然熒光信號遠遠強于生物發光,但非特異性熒光產生的背景噪音使其信噪比遠遠低于生物發光。雖然許多公司采用不同的技術分離背景光,但是受到熒光特性的限制,很難完全消除背景噪音。這些背景噪音造成熒光成像的靈敏度較低。目前大部分高水平的文章還是應用生物發光的方法來研究活體動物體內成像。
但是,熒光成像有其方便,便宜,直觀,標記靶點多樣和易于被大多數研究人員接受的優點,在一些植物分子生物學研究和觀察小分子體內代謝方面也得到應用。對于不同的研究,可根據兩者的特點以及實驗要求,選擇合適的方法。最近許多文獻報道的實驗中,利用綠色熒光蛋白和熒光素酶對細胞或動物進行雙重標記,用成熟的熒光成像技術進行體外檢測,進行分子生物學和細胞生物學研究;然后利用生物發光技術進行動物體內檢測,
進行活體動物體內研究。
| 》技術應用 |
通過活體動物體內成像系統,可以觀測到疾病或癌癥的發展進程以及藥物治療所產生的反應,并可用于病毒學研究、構建轉基因動物模型、siRNA研究、干細胞研究、蛋白質相互作用研究以及細胞體外檢測等領域。具體應用如下:
1. 標記細胞
(1) 癌癥與抗癌藥物研究
直接快速地測量各種癌癥模型中腫瘤的生長和轉移,并可對癌癥治療中癌細胞的變化進行實時觀測和評估。活體生物發光成像能夠無創傷地定量檢測小鼠整體的原位瘤、轉移瘤及自發瘤。活體成像技術提高了檢測的靈敏度,即使微小的轉移灶也能被檢測到(可以檢測到體內102個細胞的微轉移)。
Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas
Wen Xue1*, Lars Zender1*, Cornelius Miething1, Ross A. Dickins1,2, Eva Hernando3, Valery Krizhanovsky1,
Carlos Cordon-Cardo3 & Scott W. Lowe1,2
Although
cancer arises from a combination of mutations in oncogenes and tumour
suppressor genes, the extent to which tumour suppressor gene loss is
required for maintaining established tumours is poorly understood. p53
is an important tumour suppressor that acts to restrict proliferation in
response to DNA damage or deregulation of mitogenic oncogenes, by
leading to the induction of various cell cycle checkpoints, apoptosis or
cellular senescence1,2. Consequently, p53 mutations increase cell
proliferation and survival, and in some settings promote genomic
instability and resistance to certain chemotherapies3. To determine the
consequences of reactivating the p53 pathway in tumours, we used RNA
interference (RNAi) to conditionally regulate endogenous p53 expression
in a mosaic mouse model of liver carcinoma4,5. We show that even brief
reactivation of endogenous p53 in p53-deficient tumours can produce
complete tumour
regressions. The primary response to p53 was not
apoptosis, but instead involved the induction of a cellular senescence
program that was associated with differentiation and the upregulation of
inflammatory cytokines. This program, although producing only cell
cycle arrest in vitro, also triggered an innate immune response that
targeted the tumour cells in vivo, thereby contributing to tumour
clearance. Our study indicates that p53 loss can be required for the
maintenance of aggressive carcinomas, and illustrates how the cellular
senescence program can act together with the innate immune system to
potently limit tumour growth.。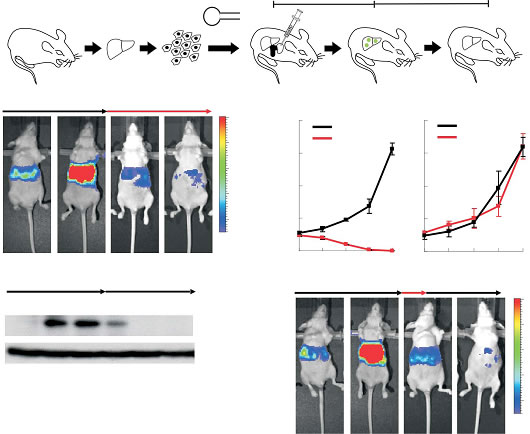
分析測試百科網訊在2018年神經科學學會年會上,布魯克發布新一代多光子、全光刺激和神經生物學應用同步成像平臺Ultima2Pplus。圖片來源于網絡Ultima2Pplus將先進的光刺激實驗(包括全息......
有一些科學技術也許在當下看來許多人都無法理解,或者說感覺并沒有實用性,但是經過時間的沉淀和證明,這些技術也許將成為我們生活的一部分,又或者對科學發展產生了極大的推動力。8月,德國弗賴堡大學的一組研究人......
據國外媒體報道,目前,科學家使用激光在活果蠅頭部成功鉆出頭發絲直徑的一個小孔,便于觀察研究果蠅大腦的運行狀況。這項研究也將用于測試蠕蟲、螞蟻和老鼠等動物。顯微觀察活體動物使科學家掌握更多關于動物生物學......
最新發現與創新中國科學技術大學光學與光學工程系李銀妹課題組,近日與上海交通大學魏勛斌教授合作,采用活體動物內的細胞,發展了動物體內細胞三維光學捕獲技術。日前,國際著名學術期刊《自然·通訊》在線發表了這......