(四)《指導原則》的核心內容
在這份長達48頁的《體外伴隨診斷設備與治療產品的共同開發指導原則》(草案)中,最重要的部分莫過于第三大部分——共同開發過程的原則,其中包括體外診斷和治療產品的監管條例 、潛在合作發展項目的IVD驗證計劃、治療產品臨床試驗設計注意事項、晚期期治療產品的IVD開發注意事項、標簽注意事項以及上市前注意事項等。
其中,關于治療產品臨床試驗與IVD的產品驗證試驗中,需要注意的事項尤為重要,本文僅用以下兩個圖表進行解讀。在進行伴隨診斷產品開發及申報過程中,可以參照大綱內容進行文檔索引。
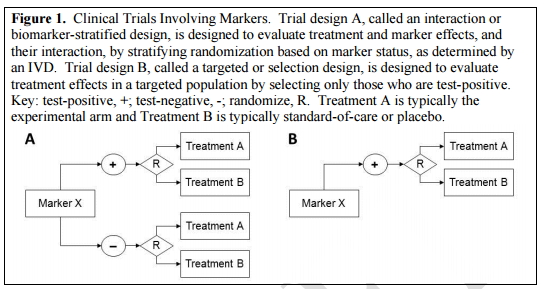
注:圖中“+”指陽性,“-”指陰性,R指隨機,A代表實驗組,B代表安慰劑組
眾所周知,在開發伴隨診斷產品時,離不開對標記物進行臨床試驗的分析與驗證。
圖1A叫做“生物標志物的分層設計”或“生物標志物的相互作用”,用以評價治療產品與標記物的效果以及它們之間的相互作用,該方法作為一種IVD產品測試,是基于標志物隨機狀態下的分層試驗;
圖1B叫做“靶向設計”或“選擇設計”,旨在評估特定人群中,誰能夠對治療方法產生陽性效果的測試。
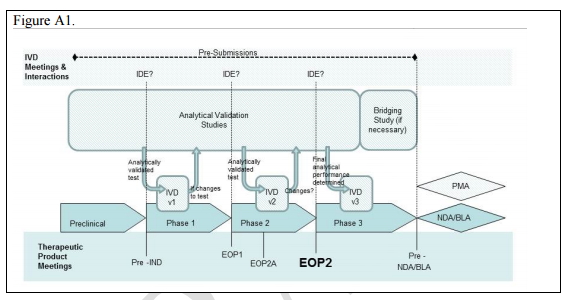
共同開發過程的關鍵點
毋庸置疑,一種治療方法的伴隨診斷的高效合作方式必須是建立在:兩個產品研發項目團隊的積極協作,甚至包括FDA系統所有相關部門間的合作與相互交流。
如圖1所示:在某個藥物/生物制品從臨床前研究到NDA/BLA(新藥上市許可/生物制品許可申請)過程中,先后需要經過臨床前研究,1、2、3期臨床試驗。
在這個過程中,相應的體外診斷測試也需要同步進行(見圖中的IVD v1、IVD v2、IVD v3)。其中針對在臨床前研究的完成時(Pre-IND)、1期臨床試驗結束點(EOP1)和2期臨床試驗結束點(EOP2)所開發的伴隨診斷測試都需要進行醫療器械臨床試驗申報(IDE)。
在上述的過程中,如何設計相應控制點的目標?如何衡量出現的偏差?誰應對哪些失誤負責?哪些信息反饋價值最大、最經濟實用等等。具體說來,企業在設計試驗時就需要要制定一些客觀的標準。
(五)FDA已經批準的28款伴隨診斷產品
根據生物探索的前期統計(截止到2016年5月24日),FDA已經批準了一些伴隨診斷檢測。這些檢測由羅氏、雅培、QIAGEN、DAKO等公司推出,主要利用qPCR、原位雜交、免疫組化等方法篩查一些腫瘤相關突變,以協助醫生選擇適當的療法。
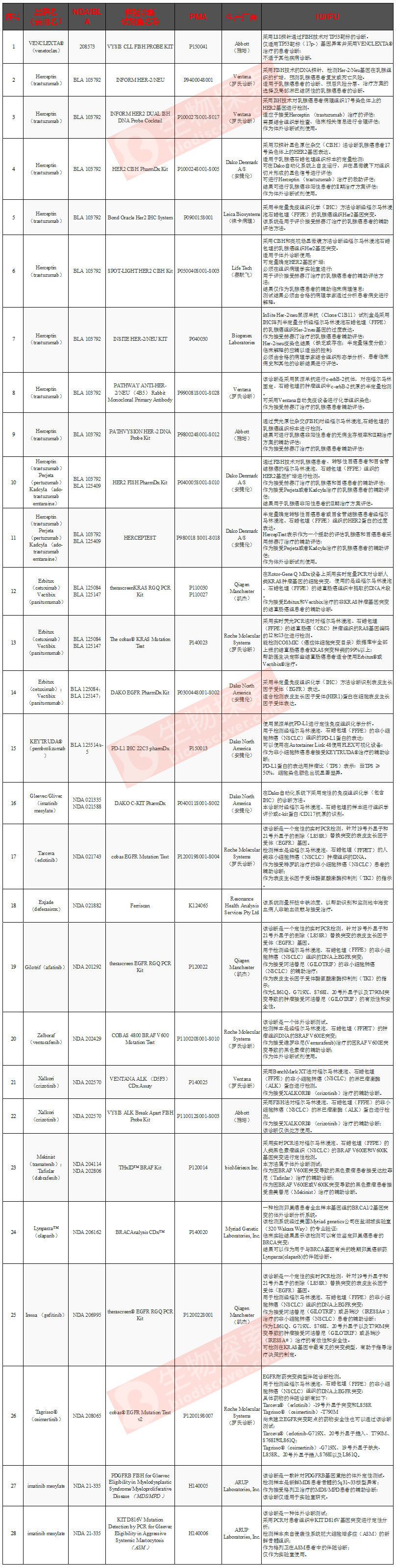
備注:NDA指新藥申請;BLA指生物制劑許可申請;PMA指上市前申請許可;IU指預期用途;IFU指使用適應癥。
(六)展望:伴隨診斷,體外診斷市場發展最快的領域
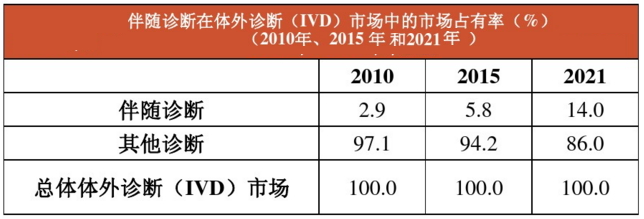
由上圖可見,伴隨診斷是一個新興市場,預計到2021年,伴隨診斷將占整個體外診斷(IVD)市場14%的份額。
目前已經有越來越多的醫療器械(IVD)公司開始與制藥企業展開合作,為后者的在研藥物/生物制品開發伴隨診斷試劑盒。
作為精準醫療的重要分支,伴隨診斷是對于預測患者針對特定藥物的治療反應至關重要。
對尚未或正在準備開展伴隨診斷合作,拓寬新興市場的藥企&診斷公司而言,仔細研究FDA發布的這份長達48頁的“葵花寶典”,必將讓“研發——試驗——上市”過程更加順利。
2023年8月28日,北京——安捷倫科技公司(紐約證交所:A)近日宣布其PD-L1檢測試劑盒(免疫組織化學法)(貨號SK006)獲得伴隨診斷(CDx)C類IVDR認證。該CDx檢測之前已擁有CE-IV......
2022年5月16日,北京——安捷倫科技公司(紐約證交所:A)近日宣布其PD-L1檢測試劑盒(免疫組織化學法)(貨號SK006)現已獲得歐盟CE-IVD認證,可用于宮頸癌。PD-L1檢測試劑盒(免疫組......
近日,美國食品和藥物管理局(FDA)計劃推出針對個體化抗癌藥物伴隨診斷的分類標簽。本月早些時候,FDA發布了相應的指南草案,概述了該分類標簽適用于個體化癌癥治療伴隨診斷的情況。該草案描述了當前伴隨診斷......
蓋倫獎(PrixGalienAward)被公認為制藥和生物醫療行業的最高榮譽,旨在褒獎醫療、科學在研究與創新領域所取得的卓越貢獻,被譽為“醫藥界的諾貝爾獎”。為了幫助大家更加深入地了解這些優秀的醫療器......
伴隨診斷是一種體外診斷技術,能夠提供有關患者針對特定治療藥物的治療反應的信息,有助于確定能夠從某一治療產品中獲益的患者群體,從而改善治療預后并降低保健開支。伴隨診斷行業概況隨著個性化醫療和精確治療時代......
2017年盛夏,基因編輯技術應用的全球領導者HorizonDiscovery公司(倫敦證券交易所:HZD),宣布其與國際知名NGS公司合作的腫瘤伴隨診斷試劑盒攜Horizon分子診斷標準品成功通過FD......
2016年,默沙東和百時美施貴寶的癌癥免疫治療藥物Keytruda及Opdivo全球銷售額分別為14億美元及38億美元,而隨著適應癥的進一步擴大以及免疫療法更多深入人心的試驗數據的公布,必將會吸引更多......
近年來,伴隨診斷作為治療的一個組成部分已經引起癌癥研究者和制藥、生物公司的廣泛關注。伴隨診斷的重要性在癌癥領域尤其凸顯,好的生物標志物可以幫助制藥公司快速鎖定目標以及高效地設計臨床實驗。摒棄“非選擇性......
2016年12月19日,美國食品和藥物管理局(FDA)批準了FoundationMedicine公司的FoundationFocusCDxBRCA產品,成為市場上第一個基于二代測序的伴隨診斷試劑盒。該......
“癌癥治療的趨勢是有針對性的個體化醫療。”在日前于廈門舉行的伴隨診斷會議上,專家指出,“伴隨診斷”和“靶向治療”是腫瘤個體化精準治療最重要的兩大工具,且伴隨診斷相較于化療更有助于提高某些患者群體的生存......