鐵死亡(ferroptosis)是近幾年發現的一種新的細胞死亡方式(2012年被命名),是在小分子物質誘導下發生的氧化性細胞死亡,具有鐵離子依賴性。鐵死亡與帕金森綜合征、胰腺癌等多種疾病相關,并發現可以通過激活或抑制鐵死亡來干預疾病的發展,因此鐵死亡成為近年來的研究熱點。
p53基因是最早發現的抑癌基因,也是研究的最多最深入的抑癌基因,p53基因主要通過誘導細胞周期停滯、誘導細胞凋亡等方式抑制癌癥,最近的研究表明,p53基因除了誘導細胞凋亡,還可以誘導細胞鐵死亡。但p53誘導細胞鐵死亡的具體因子和分子機制仍然不清楚。
2019年4月8日,哥倫比亞大學顧偉教授團隊在 Nature 子刊 Nature Cell Biology 雜志發表了題為:ALOX12 is required for p53-mediated tumoursuppression through a distinct ferroptosispathway 的研究論文。
該論文發現并證實,ALOX12基因是p53介導的通過鐵死亡抑制腫瘤進展所必須的。揭示了p53誘導鐵死亡的分子機制,為通過鐵死亡來干預疾病的研究奠定了基礎。

鐵死亡(ferroptosis) 是在小分子物質誘導下發生的氧化性細胞死亡形式,具有鐵離子依賴性。由細胞內脂質活性氧(ROS)生成與降解的平衡失調所致。
鐵死亡與帕金森綜合征、胰腺癌、糖尿病并發癥、腎功能衰竭、心腦血管疾病等多種疾病相關,并發現可以通過激活或抑制鐵死亡來干預疾病的發展,因此鐵死亡成為近年來的研究熱點。
鐵死亡受到細胞內信號通路的嚴密調控,鐵死亡主要由谷胱甘肽過氧化物酶4(GPX4)調控,一旦GXP4異常,就會導致細胞抗氧化能力降低、ROS堆積、最終引起細胞鐵死亡。

實驗表明,p53的激活會促進細胞鐵死亡,然而,令人驚訝的是,p53激活對GPX4功能沒有明顯影響。這說明,p53并非通過GPX4來誘導鐵死亡。
細胞中的細胞脂質過氧化物的水平除了由GPX4調控外,還可以通過脂氧合酶調控。哺乳動物脂氧合酶家族由(ALOXE3、ALOX5、ALOX12、ALOX12B、ALOX15和ALOX15B)組成。
作者通過RNA干擾(RNAi)介導的功能喪失篩選,確定確定這些脂氧合酶是否是p53介導的鐵死亡所必需的。定量PCR分析證實,六種脂氧合酶的每一種的表達均通過RNAi介導的敲低而單獨降低。

通過RNAi敲低了ALOX12的表達,鐵死亡被顯著且特異性地阻斷,其他五種脂氧合酶中的任何一種都沒有。蛋白質免疫印跡分析顯示ALOX12消耗對p53水平或p53介導的胱氨酸/谷氨酸轉運蛋白SLC7A11的下調沒有影響。
通過CRISPR/Cas9敲除ALOX12,細胞的鐵死亡也被抑制了,這些研究表明,ALOX12是p53介導的鐵死亡所必須的。
進一步研究表明,ALOX12失活減少了由活性氧應激誘導的p53介導的細胞凋亡,并且在異種移植腫瘤模型中消除了p53對腫瘤生長的抑制。
ALOX12基因位于人類染色體17p13.1上,這是人類癌癥中單等位基因缺失的熱點。一個ALOX12等位基因的丟失足以加速Eμ-Myc淋巴瘤模型中的腫瘤發生。此外,來自人類癌癥的ALOX12錯義突變消除了其對多不飽和脂肪酸氧合能力,并誘導p53介導的鐵死亡。進一步表明ALOX12對p53介導的鐵死亡至關重要。
作者還發現,ALOX12對于由小分子抑制劑erastin或GPX4抑制劑誘導的鐵死亡是不必要的。相反,ACSL4是GPX4抑制劑誘導鐵死亡所必需的,但對于p53介導的鐵死亡是不必要的。
雖然許多研究表明GPX4抑制作為誘導細胞凋亡的中心節點,但該研究數據確定了p53誘導鐵死亡的獨特機制。
該研究發現并證實了p53能夠通過對SLC7A11的轉錄抑制來間接激活ALOX12功能,從而導致ROS應激后ALOX12依賴性的鐵死亡。
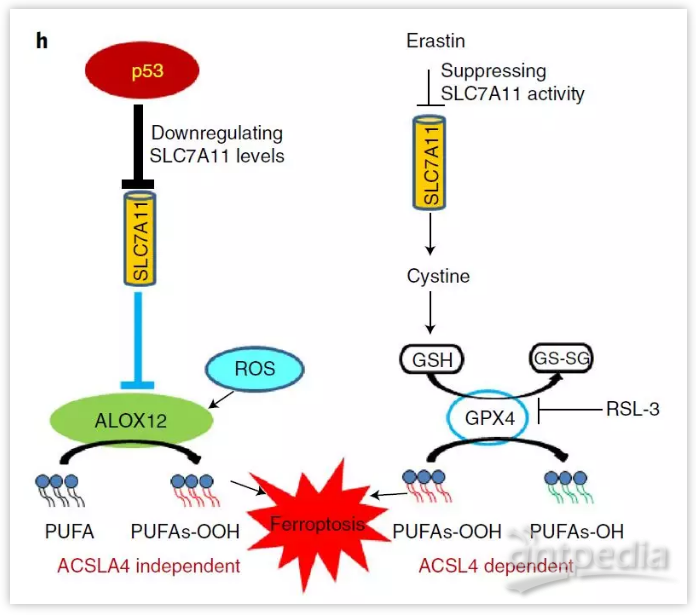
總的來說,該論文發現并證實了ALOX12基因是p53介導的通過鐵死亡抑制腫瘤進展所必須的。從而揭示了p53誘導鐵死亡的分子機制,也為通過鐵死亡來干預疾病的研究奠定了基礎。
近日,西北農林科技大學化學與藥學院生命分析化學團隊王進義、袁茂森等通過設計并合成了能夠同時靈敏檢測羥基自由基(·OH)與谷胱甘肽(GSH)的雙位點熒光傳感器,實現了對·OH-GSH氧化還原的成像監測,......
近日,西北農林科技大學化學與藥學院生命分析化學團隊王進義、袁茂森等通過設計并合成了能夠同時靈敏檢測羥基自由基(·OH)與谷胱甘肽(GSH)的雙位點熒光傳感器,實現了對·OH-GSH氧化還原的成像監測,......
近年來,免疫檢查點阻斷(ICB)療法在癌癥治療領域取得了令人矚目的成果。其治療過程可激起以T細胞為核心代表的抗腫瘤反應,這一過程還伴隨著腫瘤微環境(TME)的重塑和全身系統免疫的改變。然而,在結直腸癌......
從中國科學院動物研究所獲悉,該所李偉研究員與周琪研究員團隊開發的逆轉座子基因工程新技術,首次實現以RNA為媒介的基因精準寫入,有望為遺傳病、腫瘤等疾病帶來更高效、更安全、更低成本的全新治療方式,為新一......
基因組DNA是生命的藍圖,對基因組DNA實現任意尺度的精準操作代表對生命藍圖進行修改繪制的底層能力,是基因工程技術發展的核心。以CRISPR基因編輯技術為代表的技術進步實現了基因組單堿基和短序列尺度的......
記者9日從中國科學院動物研究所獲悉,該所李偉研究員與周琪研究員團隊開發的逆轉座子基因工程新技術,首次實現以RNA為媒介的基因精準寫入,有望為遺傳病、腫瘤等疾病帶來更高效、更安全、更低成本的全新治療方式......
在近日召開的國務院常務會議上,國務院總理李強主持并審議通過了備受矚目的《全鏈條支持創新藥發展實施方案》。這一舉措對于推動中國生物醫藥領域的創新發展具有深遠影響,尤其是細胞與基因療法行業,有望因此迎來全......
在近日召開的國務院常務會議上,國務院總理李強主持并審議通過了備受矚目的《全鏈條支持創新藥發展實施方案》。這一舉措對于推動中國生物醫藥領域的創新發展具有深遠影響,尤其是細胞與基因療法行業,有望因此迎來全......
7月3日,中信湘雅生殖與遺傳專科醫院和深圳華大基因科技有限公司簽署戰略合作協議,雙方將共建“中信湘雅-華大DCSlab”科研實驗平臺,推動基因組學、基因檢測、輔助生殖技術及精準醫療等領域的科學研究。簽......
表觀遺傳指的是在不改變DNA序列的情況下,基因表達和生物性狀的可繼承變化。細胞命運決定包括細胞身份的維持和轉換,這就涉及到表觀遺傳信息的繼承性和可塑性,是生命科學領域的重點前沿方向。生命的"......