2020年3月份即將結束了,3月份Cell期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。
1.Cell:我國科學家從結構和功能角度揭示SARS-CoV-2利用人ACE2進入細胞機制
doi:10.1016/j.cell.2020.03.045
病毒感染始于病毒顆粒與宿主表面細胞受體的結合。因此,受體識別是病毒的細胞和組織嗜性(tropism)的一個重要決定因素。此外,病毒結合其他物種的相應受體的功能獲得也是物種間傳播的先決條件。有趣的是,除了HCoV-OC43和HKU1均與糖分子結合從而與細胞附著外,其他的四個人類冠狀病毒均將蛋白肽酶識別為受體。HCoV-229E與人氨基肽酶N(hAPN)結合,而MERS-CoV與人二肽基肽酶4(hDPP4或hCD26)相互作用。盡管SARS-CoV和hCoV-NL63屬于不同的冠狀病毒屬,但是它們均與人類血管緊張素轉化酶2(hACE2,即人ACE2)相互作用以進入宿主細胞。在COVID-19疫情爆發后,中國科學家迅速確定SARS-CoV-2也利用hACE2進入細胞。
在冠狀病毒中,這種進入過程是由嵌入包膜的位于病毒表面的刺突糖蛋白(S蛋白)介導的。在大多數情況下,S蛋白會被宿主蛋白酶切割為分別負責受體識別和膜融合的S1和S2亞基。 S1可以進一步分為N末端結構域(NTD)和C末端結構域(CTD),兩者都可以充當受體結合實體(比如,SARS-CoV和MERS-CoV都利用S1 CTD識別受體,因而稱為受體結合結構域(RBD),然而小鼠肝炎冠狀病毒利用它的S1 NTD與受體結合。在此之前,SARS-CoV-2 S蛋白中負責與hACE2相互作用的區域仍然是未知的。
在一項新的研究中,來自中國科學院、深圳市第三人民醫院、山西農業大學、安徽大學、四川大學、中國科技大學和香港大學的研究人員利用免疫染色和流式細胞儀測定技術,首先鑒定出S1 CTD(SARS-CoV-2-CTD)是SARS-CoV-2中與hACE2受體相互作用的關鍵區域。他們隨后解析出SARS-CoV-2-CTD與hACE2結合在一起時的分辨率為2.5 ?的晶體結構,揭示了一種整體上與SARS-CoV RBD(下稱SARS-RBD)相類似的受體結合模式。但是,與SARS-RBD相比,SARS-CoV-2-CTD與hACE2形成更多的原子相互作用,這與顯示更高的受體結合親和力的數據相關。相關研究結果以論文手稿的形式在線發表在Cell期刊上,論文標題為“Structural and functional basis of SARS-CoV-2 entry by using human ACE2”。
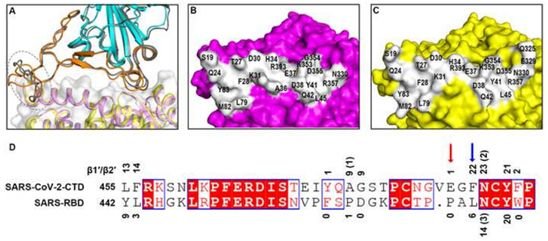
圖片來自Cell, 2020, doi:10.1016/j.cell.2020.03.045。
值得注意的是,一組單克隆抗體(mAb)以及針對SARS-S1/RBD的鼠多克隆抗血清無法與SARS-CoV-2 S蛋白結合,這表明SARS-CoV和SARS-CoV在抗原性上存在顯著差異,并且提示著先前開發的基于SARS-RBD的候選疫苗不太可能對SARS-CoV-2預防有任何臨床益處。
2.全文編譯!復旦大學在Cell期刊上發文,從基因組學角度揭示SARS-CoV-2的起源和出現
doi:10.1016/j.cell.2020.03.035
新型人類冠狀病毒SARS-CoV-2(之前稱為2019-nCoV)的持續大流行引起了全球的極大關注。我們和中國的其他人參與了對這種病毒的初始基因組測序。在本文中,我們描述了針對SARS-CoV-2的出現,這些基因組數據揭示了什么,并討論了我們對其起源理解上所存在的差距。
在英國愛丁堡大學Andrew Rambaut博士的幫助下,我們于2020年1月11日(格林威治標準時間, GMT)早些時候在開放存取的virological.org網站(http://virological.org/)上發布了這種病毒的基因組序列。不久之后,中國疾控中心在公眾可訪問的GISAID數據庫(https://www.gisaid.org/)上類似地發布了SARS-CoV-2基因組序列(以及相關的流行病學數據)。在撰寫本文時,已有近200個SARS-CoV-2基因組可公開獲得,這代表了來自中國及其他地區的這種病毒的基因組多樣性,并提供了可自由獲取的全球資源。重要的是,SARS-CoV-2基因組序列數據的發布促進了診斷測試和感染性克隆(infectious clone)的快速開發。研發有效疫苗和抗病毒藥物的競賽正在進行中,而且針對抗病毒藥物的臨床試驗正在逐步展開。
盡管SARS-CoV和MERS-CoV與SARS-CoV-2密切相關并且都有蝙蝠宿主,但這兩種病毒之間的生物學差異卻很明顯。如上所述,SARS-CoV-2的傳染性明顯更高,從而導致與SARS-CoV和MERS-CoV完全不同的流行病學動態。在后兩種病毒中,病例數的增長相對較慢,而MERS-CoV從未完全適應人類傳播:大多數病例是由于阿拉伯半島的駱駝溢出造成的,僅零星地發生人與人之間的傳播。相比之下,SARS-CoV-2在當地的顯著傳播最讓人吃驚。確定支撐這種傳播能力的病毒學特征顯然是當務之急。
SARS-CoV-2似乎將不可避免地成為人類中的第五種地方性冠狀病毒(其他四種為HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1),并且目前正在完全易感人群中傳播。冠狀病毒顯然具有跨越物種界限并適應新宿主的能力,這使得預測未來會有更多的病毒出現變得很簡單,不過尚不清楚為何相比于一些其他的RNA病毒,冠狀病毒具有這種能力。至關重要的是,對動物冠狀病毒的監視應包括蝙蝠以外的動物,這是因為中間宿主的作用可能非常重要,從而為病毒在人類中的出現提供了更直接的途徑。
鑒于野生動物中病毒的多樣性以及它們的持續進化,可以說,降低未來疫情爆發風險的最簡單最具成本效益的方法是盡可能限制我們對動物病原體的接觸。盡管我們與動物世界的親密關系意味著我們無法建立堅不可摧的屏障,但是針對非法野生動物貿易采取更強有力的行動,以及將所有野生哺乳動物(也許還有禽類)從濕貨市場中清除將提供一個重要的緩沖。
3.Cell:重磅!揭示新型冠狀病毒SARS-CoV-2進入宿主細胞機制
doi:10.1016/j.cell.2020.02.052
冠狀病毒的刺突(S)蛋白(下稱S蛋白)有助于病毒進入靶細胞。細胞進入取決于S蛋白的表面亞基S1與細胞受體的結合,這種結合有助于病毒附著至靶細胞的表面。另外,細胞進入需要通過細胞蛋白酶激活S蛋白(S protein priming),這需要在S蛋白的S1/S2和S2'位點切割這種蛋白,并允許病毒膜和細胞膜融合,這一過程由S蛋白的S2亞基驅動。SARS-CoV S蛋白以血管緊張素轉換酶2(ACE2)作為進入受體,并利用細胞絲氨酸蛋白酶TMPRSS2激活S蛋白。已在原子水平上闡明了SARS-CoV S/ACE2界面,發現ACE2的使用效率是SARS-CoV傳播能力的關鍵決定因素。SARS-CoV S蛋白和SARS-CoV-2 S蛋白具有大約76%的氨基酸序列一致性(sequence identity)。然而,人們仍不清楚SARS-CoV-2 S蛋白是否像SARS-CoV S蛋白那樣使用ACE2和TMPRSS2進入宿主細胞。
在一項新的研究中,德國研究人員提供證據表明SARS-CoV-2的宿主細胞進入依賴于SARS-CoV受體ACE2,并且可以被臨床證明的細胞絲氨酸蛋白酶TMPRSS2抑制劑阻斷,而且TMPRSS2被SARS-CoV-2用于S蛋白激活。此外,這項研究還發現針對SARS-CoV產生的抗體反應可以至少部分地抵御SARS-CoV-2感染。這些結果對人們對SARS-CoV-2的可傳播性和發病機理的理解具有重要意義,并揭示了進行治療性干預的靶標。相關研究結果以論文手稿的形式在線發表在Cell期刊上,論文標題為“SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically-proven protease inhibitor”。
這一關于SARS-CoV-2利用S蛋白與ACE2的結合進入宿主細胞的發現也被Zhou和他的同事們報道過(Nature, 2020, doi:10.1038/s41586-020-2012-7),它提示著這種冠狀病毒像SARS-CoV那樣靶向一系列細胞。在肺部,SARS-CoV主要感染肺細胞和巨噬細胞。然而,ACE2的表達不僅限于肺部,而且還觀察到SARS-CoV在ACE2+組織中的肺外擴散。雖然還需要比較SARS-CoV S蛋白和SARS-CoV-2 S蛋白對ACE2的親和力,但是這些研究人員認為可以預期SARS-CoV-2也會如此。
4.Cell:重磅!揭示新型冠狀病毒SARS-CoV-2刺突糖蛋白的結構、功能和抗原性
doi:10.1016/j.cell.2020.02.058
在一項新的研究中,美國華盛頓大學醫學院生物化學系的David Veesler博士及其團隊報道人ACE2可調節SARS-CoV-2 S蛋白介導的細胞進入,從而確定它是這種新出現的冠狀病毒的功能性受體。SARS-CoV-2 S蛋白的結構域B與人ACE2結合的親和力與來自與2002-2003年SARS疫情相關的SARS-CoV分離株的S蛋白的結構域B相當,這表明SARS-CoV-2 S蛋白的結構域B與人ACE2具有較高的結合親和力。與人ACE2的緊密結合可以部分解釋SARS-CoV-2在人類中的有效傳播,就像SARS-CoV的情況一樣。相關研究結果以論文手稿的形式在線發表在Cell期刊上,論文標題為“Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein”。
他們鑒定出在SARS-CoV-2 S蛋白的S1/S2亞基邊界存在意料之外的弗林蛋白酶(furin)切割位點,這個位點在S蛋白的生物合成過程中被切割,這種新特征可將這種冠狀病毒與SARS-CoV和SARSr-CoV區分開來。正如針對一些高致病性禽流感病毒和致病性新城疫病毒的報道那樣,移除這種切割基序會適度影響SARS-CoV-2 S蛋白介導的VeroE6或BHK細胞進入,但是這可能有助于擴大這種冠狀病毒的宿主趨向性。
他們解析出SARS-CoV-2 S蛋白胞外結構域三聚體的低溫電鏡結構,并揭示它具有多個結構域B構象,這使人想起了先前有關SARS-CoV S蛋白和MERS-CoV S蛋白的報道。他們證實SARS-CoV S蛋白小鼠多克隆血清有效抑制SARS-CoV-2 S假病毒進入靶細胞。這些結果為設計可廣泛預防SARS-CoV-2、SARS-CoV和SARS-CoV的疫苗鋪平了道路。
5.Cell:好狡猾!結核菌產生一種觸發咳嗽的分子來促進自身傳播
doi:10.1016/j.cell.2020.02.026
在一項新的研究中,來自美國德克薩斯大學的研究人員發現作為一種引起致命性肺部疾病的細菌,結核分枝桿菌(Mycobacterium tuberculosis)似乎通過產生一種觸發咳嗽的分子來促進自身傳播。這一發現可能導致人們開發出阻止結核病擴散的新方法。相關研究結果近期發表在Cell期刊上,論文標題為“Mycobacterium tuberculosis Sulfolipid-1 Activates Nociceptive Neurons and Induces Cough”。
論文通訊作者Michael Shiloh博士和他的同事們推測作為一種引起結核病的細菌,結核分枝桿菌本身可能產生一種觸發氣道中神經的物質,它引起結核病患者咳嗽,從而允許這種疾病傳播。為了驗證這個想法,這些研究人員依靠豚鼠,即一種經常被用來研究結核病和咳嗽的實驗室動物。盡管豚鼠已被用作結核分枝桿菌感染的實驗模型已有一個多世紀的歷史,但尚不清楚這種疾病是否引起這些動物咳嗽。為了解答這個問題,Shiloh和他的同事們將感染了結核分枝桿菌的豚鼠放在特殊的腔室中,記錄下由咳嗽引起的壓力和體積變化。果然,感染結核分枝桿菌的豚鼠要比未感染的豚鼠咳嗽得多。
在利用來自結核分枝桿菌以及多種其他分枝桿菌的成分開展一系列實驗后,Shiloh團隊最終鑒定出一種稱為硫脂1(sulfolipid-1, SL-1)的分枝桿菌細胞表面脂肪分子是激活實驗室中培養的神經元的主要分子。這種激活反應也發生在人類的痛覺神經細胞中,這表明SL-1及其功能已通過在不同哺乳動物物種的進化中得以保存。重要的是,當豚鼠暴露于純化的SL-1時,它們確實會咳嗽。
為了表明SL-1是咳嗽的罪魁禍首,這些研究人員用經過基因改造后無法產生SL-1的結核分枝桿菌菌株感染豚鼠。這些豚鼠表現出結核病的所有典型癥狀,但并未出現咳嗽,這導致他們得出結論:SL-1對于在結核分枝桿菌感染期間觸發咳嗽至關重要。
6.Cell突破:恢復免疫系統可以支持腦損傷后的修復
doi:10.1016/j.cell.2020.02.013
研究小組使用動物模型來研究受傷后免疫系統如何與腦神經細胞相互作用,以及這如何影響學習和記憶的能力。
昆士蘭大學生物醫學科學學院和昆士蘭腦研究所的研究人員Jana Vukovic博士說,到目前為止,大腦的免疫細胞,即小膠質細胞,被認為是引起炎癥的原因,會導致受傷后的認知能力下降。她說:"然而,當我們從老鼠身上移除小膠質細胞時,我們驚訝地發現它們的行為和修復腦組織的能力完全沒有變化。"
Vukovic博士的團隊隨后清除了小神經膠質細胞,讓它們重新在大腦中繁殖,發現這大大增加了大腦的修復能力。"恢復活力的小膠質細胞改善了小鼠的學習和記憶,防止了組織損失,刺激了神經元的誕生,"Vukovic博士說。"我們已經表明,小膠質細胞在某種程度上被誤解了,我們需要更多地了解它們如何支持和刺激促進修復的途徑。"
7.Cell重磅:揭示精子和卵細胞基因組整合的機制
doi:10.1016/j.cell.2020.02.020
精子進入卵子,胚胎發育,最后嬰兒出生。那么母親的半基因組是如何與父親的半基因組融合形成一個新的人類基因組的呢?事實證明,對于受精過程中這些相對短暫但卻至關重要的初始階段,研究人員并不是很了解。加州大學圣地亞哥醫學院的研究人員發現,SPRK1酶在解開精子基因組、剔除特殊包裝蛋白、打開父方DNA并進行重大重組方面邁出了第一步--所有這一切都在幾小時內完成。這項研究發表在2020年3月12日的《Cell》雜志上。
"在這項研究中,我們只是對回答生命起源的基本問題感興趣,"加州大學圣地亞哥分校醫學院細胞和分子醫學系的資深作者Fu Xiangdong博士說。"但在這個過程中,我們發現了一個步驟,可能會對一些人造成障礙,導致一對夫婦的生育困難。現在我們知道SPRK1在這里起作用,它在不孕中的潛在作用可以進一步探索。"
8.Cell:開發出高靈敏檢測疾病相關突變的SNIPR技術
doi:10.1016/j.cell.2020.02.011
在一項新研究中,來自美國亞利桑那州立大學等研究機構的研究人員描述了一種檢測點突變的新方法。它可以應用于活細胞中,從而提供了一種快速、高度準確和廉價的方法來鑒定與人類健康有關的突變。相關研究結果發表在2020年3月5日的Cell期刊上,論文標題為“Precise and Programmable Detection of Mutations Using Ultraspecific Riboregulators”。論文通訊作者為亞利桑那州立大學的Alexander A. Green博士和Hao Yan博士。
這種方法可與基于試紙的診斷測試(由Green及其同事們開發)結合使用,能夠在人體熱量驅動的反應中查明突變并顯示基于顏色的讀數。
Green說,“我們使用我們的技術完成的工作是開發一種新的可移植的方法來檢測你想要檢測的RNA之間的微小序列差異。有了這種我們稱為SNIPR(Single-Nucleotide-Specific Programmable Riboregulator)的系統,我們就有能力根據單個核苷酸差異識別任何RNA序列。”
這種技術非常靈敏,甚至可以檢測到表觀遺傳變化,即對遺傳序列的細微化學修飾,可以調節基因表達而無需改變單個堿基的身份。
9.Cell:震驚!研究發現腸道微生物代謝物會增加心血管疾病風險!
doi:10.1016/j.cell.2020.02.016
克利夫蘭診所的研究人員已經確認了一種腸道微生物的副產品--苯乙酰谷氨酰胺(PAG)--與心血管疾病的發展有關,包括心臟病、中風和死亡。這項研究近日發表在《Cell》雜志上。
苯丙氨酸是一種存在于許多食物中的氨基酸,包括以植物和動物為基礎的蛋白質來源,如肉類、豆類和大豆。勒納研究所心血管與代謝科學系主任、米勒家族心臟血管胸科研究所預防心臟病和康復科共同主任Stanley Hazen領導的研究小組發現當苯丙氨酸被腸道內的微生物分解后,它產生的副產品(代謝物)PAG最終會出現在血液中,導致心臟病。
"在過去的十年里,有越來越多的數據表明,腸道微生物在健康中扮演著重要的角色,尤其是在它與心臟病相關的時候," Hazen博士說,他同時也是克利夫蘭診所微生物組和人類健康中心的主任。"我們發現,血液中的PAG會以幾種不同的方式增加心血管疾病的風險。"
10.Cell新突破:將受體固定在癌細胞表面,免疫治療精準打擊
doi:10.1016/j.cell.2020.02.019
一種安全可控的體內內吞操作可能具有破壞性的治療潛力。為此,來自昆士蘭大學的研究人員領導的研究小組證明了抗吐劑/抗精神病藥丙氯哌嗪可被重新使用,以可逆地抑制治療性單克隆抗體靶向的膜蛋白的體內內吞作用。
研究人員在人腫瘤體外實驗中直接證明了這一點。短暫的抑制內吞可增強靶細胞的可用性,并提高自然殺傷細胞介導的抗體依賴性細胞細胞毒性(ADCC)的效率。ADCC是IgG1抗體誘導的臨床反應的介導者,研究人員在這項研究中利用西妥昔單抗、曲妥珠單抗和阿韋單抗進行了證明。
對下游信號通路的廣泛分析排除了靶標毒性。通過克服反應性差或耐藥腫瘤常見的藥物靶點的異質性,臨床應用可逆性內吞抑制可顯著提高ADCC介導的治療性抗體的臨床療效。
總的來說,這項研究提出了一種提高治療性抗體ADCC潛力的策略;表明暫時抑制細胞內吞作用增加了腫瘤細胞抗原的呈遞;丙氯哌嗪可用于增強單克隆抗體的抗腫瘤作用;這種方法可能降低腫瘤細胞對多種IgG1抗體反應的異質性。
2020年3月份即將結束了,3月份Cell期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。1.Cell:我國科學家從結構和功能角度揭示SARS-CoV-2利用人ACE2進入細胞機制do......
2019年10月份Cell期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。1.Cell:開發出光學混合篩選技術,可在幾天內篩選人細胞中的數千個基因doi:10.1016/j.cell.......
7月份即將結束了,7月份Cell期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。1.Cell:中科院生物物理所王艷麗/章新政課題組從結構上揭示Cas13a切割RNA機制doi:10.1......