FDA局長Scott Gottlieb博士近日發表了關于再生醫學產品和基因療法的演講(圖片來源:FDA官網)
Gottlieb博士表示,產生持久療效的基因療法屬于更大的再生醫學產品的一部分。傳統的藥物審評中,80%的審查都集中在臨床部分,20%會專注產品自身的問題,這個普遍原則在細胞和基因療法方面幾乎完全顛倒過來。對于基因療法監管方面,FDA打算發布一套指導文件草案,闡明基因療法產品的制造和臨床開發框架。下面是Gottlieb博士的完整演講:
我們正處于細胞和基因治療的關鍵時刻。這些療法有望治療成百上千種罕見疾病和常見疾病。在很長一段時間里,基因療法主要存在于理論上。現在,它們變成了現實。我預計基因療法很快就會成為人類治療各種疾病的主要方式。
我們已經到達了科學的轉折點,為這些應用機會打開了大門。其中之一就是基因的有效載體的出現。這一突破的意義可以參考單克隆抗體領域的技術進步歷史。開發完全人源化抗體的能力是一個科學轉折點,它推動了抗體最終成為藥物治療的主要手段。在這種情況下,產品創新徹底改變了治療機會。同樣的概念也適用于基因療法。可靠載體的出現是基因療法和CAR-T細胞療法發展的一個轉折點。
但基因療法也帶來了新的挑戰。
為了擁抱這一技術進步,并應對這些挑戰,FDA正在進行細胞和基因治療的新型臨床試驗設計的應用科學研究。我們也在努力通過使用所有的監管途徑制定藥物加快開發計劃。這包括使用”突破性療法”認定,以及最近的再生醫學先進療法認定,也稱為RMAT(Regenerative Medicine Advanced Therapy designation)認定。
作為2017年11月發布的再生醫學框架的一部分,FDA提出了如何應用RMAT認定以及其他加快新產品開發的新舉措的指導草案。我們將很快發布一個類似的框架,討論如何解決基因療法產品的制造和開發途徑。

▲2017年11月發布的再生醫學框架草案中,FDA提到將采取5種途徑加快再生醫學產品審批(圖片來源:FDA官網)
我今天想談兩件事。首先,我想回顧一下FDA去年推進的基于細胞的再生醫學療法政策,這些努力涉及我想談的第二個主題——我們計劃發布關于基因療法的政策。
我們2017年11月發布的再生醫學框架闡明了現有的組織法規,并描述了我們對這些產品的合規和監督政策。我們的目標是促進開發和提供安全有效的再生醫學產品。以及在必要時集中執法行動的框架,以確保不安全的產品不會被非法銷售給病人。
這個框架為實現這些目標提供了推動力和拉動力。它梳理了滿足FDA上市前許可條款(pre-market licensing provisions)的條件,并描述了開發這些產品并尋求FDA批準的有效途徑。
根據FDA的建議,只要小型開發者遵循通用的制造協議,就可以將他們的數據匯集起來。這將使小型機構能夠更有效地滿足批準程序的證據要求,為他們獲得個人產品許可提供一條途徑。
該框架還描述了如果上市前許可產品一旦被非法銷售并使病人處于危險之中,FDA打算如何采取執法。最近,FDA向法院尋求永久禁令,阻止兩家干細胞診所在未經FDA批準的情況下銷售干細胞產品,這兩個干細胞診所的生產與目前的GMP要求有很大差距。
再生醫學領域繼續擴大,我們致力于根據需要調整政策,以確保我們正在評估的這些產品所帶來的不斷變化的風險和受益。自該計劃于2016年12月開始實施以來,截至今年4月底,共有62份RMAT認定材料提交,FDA頒發了19個認定。在這19種產品中,有14種也獲得了孤兒藥認定。表明該計劃如何促進了罕見疾藥物的開發。
談到基因療法,讓我想起了我們正在做的上述事情。某些基因療法可能符合RMAT認定。產生持久療效的基因療法可能是更大的再生醫學產品的一部分。基因療法的發展速度驚人。麻省理工學院發表的一篇論文基于2017年的930種在研產品線預測,到2022年底,將有約40種基因療法產品獲得FDA批準。麻省理工學院還預測,這些批準的基因療法中45%都將用于治療癌癥。
我不知道他們預測的數量是否準確。但我知道從趨勢上,這個預測是正確的。就在去年,我們看到了前三種基因療法獲得批準: 兩種治療血液癌癥的基于細胞的基因療法,以及治療一種遺傳性視網膜萎縮癥的直接型基因療法。基因療法正在從承諾變成現實。這些最近批準的產品只是冰山一角。
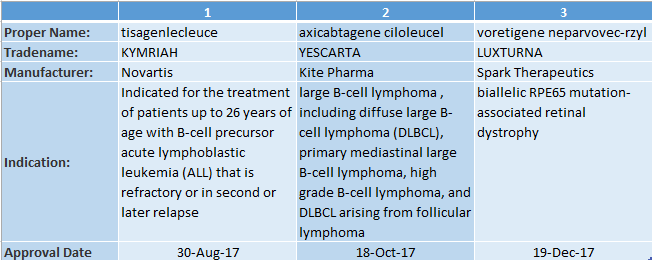
▲FDA批準的3種基因療法(信息來源:FDA官網)
FDA共收到了500多個涉及基因治療產品的新藥申請(NDA)。僅去年一年,我們就收到了100多份這樣的申請。充分表明了這一研究領域的熱度。
這些都是非凡的進展。這些產品有可能治愈一些最難治的遺傳性疾病。這些進步為廣大人群帶來希望,如罕見代謝疾病患兒的父母,以及患有更常見的疾病的人,如糖尿病和心臟衰竭。
在監管方面,為了在基因療法的開發方面取得進展,正如我先前提到的,FDA打算發布一套指導文件草案,闡明基因療法產品的制造和臨床開發框架。許多新的指導意見將集中在與產品有關的問題上,但這些指導也將為其他領域的臨床開發提供建議。
傳統的藥物審評中,80%的審批都集中在臨床部分,20%會專注產品自身的問題,我認為這個普遍原則在細胞和基因療法方面幾乎完全顛倒過來。最初的臨床療效往往是在早期就建立起來的,有時是在一小部分病人身上。更具挑戰性的問題是產品的制造和質量控制,以及改變或者擴增的問題,在基因插入前需要放到一個載體上,這會改變載體的構象,從而從根本上改變整個產品的安全性或效果。
還有一個問題是反應的持久性,任何具有合理規模的上市前試用都往往不能完全回答這個問題。對于某一些產品,即使在批準時也會有一些不確定性。但是這些產品最初的目標是治療嚴重疾病,其中許多還是缺乏治療手段的致命疾病。在這些情況下,FDA一直愿意接受更多的不確定性,以便于及時獲得有希望的療法,通過加速批準、突破性療法認定或RMAT認定這些舉措,這是美國國會給予FDA的方向。
當我們采用這些方法來加速開發和批準具有高潛力、但其安全性或療效有一些不確定性的治療方法,以實現未滿足的臨床需求時,我們通常會遵循嚴格的審評標準。這些療法需要在上市后采取后續研究,以回答可能仍然存在的產品風險或長期有效性的問題。
加速審批有助于實現這種謹慎的平衡。這使FDA有機會在藥物開發過程的早期就批準非常有前景的產品,基于可合理預測臨床益處的替代指標。與此同時,它也給予FDA強有力的權力,要求進行上市后研究證實這些療效。
因此,作為我們綜合性政策框架的一部分,我們將推出的指導性文件中包含將為某些基因療法產品設計潛在的加速審批終點的文件。我們關注的第一個治療領域是血友病,基因療法能讓凝血因子的產量變得正常,在某些情況下,凝血因子的產量可能足以作為基因療法益處的替代指標。
在這些情況下,出血率下降的證據可以在批準后得到證實,因為我們繼續研究產品的長期安全性和耐用性。我們將發布的其他指導文件,涉及與基因治療產品相關的特殊制造和臨床問題。
通過向開發者提供制造參數,安全措施和臨床開發路徑,FDA希望促進基因療法領域更大的創新發展。一旦這些指導文件草案發布,我們將期待大家參與討論。我們重視知情的利益相關方,例如再生醫學聯盟(Alliance for Regenerative Medicine)的加入。
我們看到的與基因療法產品相關的挑戰是我們可以通過合作解決的問題。雖然基因療法有可能同時治療常見疾病和罕見疾病,但目前它對于7000多種罕見疾病的患者來說希望更大。為這些從最少不足一百,到多則上萬患者的每一種罕見疾病開發產品,對于我們所有人來說充滿挑戰。
顯然,我們要利用現有的所有創新方法進行臨床開發,包括使用新穎的以患者為中心的終點和試驗設計。此外,我們要運用所有現有的工具,作為FDA加快開發計劃的一部分,以促進及時開發安全有效的產品,包括使用擴大的規定獲取確認證據,以便通過《21世紀治愈法案》的再生醫學規定加速批準治療方法。

▲21st Century Cures Act(圖片來源:FDA官網)
在這方面,注冊管理機構和真實世界證據(real-world evidence)的使用可能會發揮越來越重要的作用。因此,作為2019財政年度預算申請的一部分,我們正在尋求新的資源來擴大我們在新藥上市后收集數據的能力。我們的一個目標是建立新產品批準后能對其安全問題進行更多實時監控的系統。
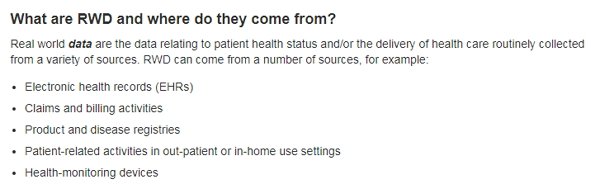
▲FDA公布的真實世界證據的來源(圖片來源:FDA官網)
盡管針對小眾人群的藥品臨床開發顯然具有挑戰性,但目前似乎還有另一個更大的挑戰正在減緩基因療法的發展。這一挑戰是細胞和基因療法制造能力的局限。
更具體地說,有兩個問題需要解決。第一個是技術性的,第二個主要是概念性的。我想依次解決這兩個問題。
首先,關于技術問題: 目前生產基因治療載體(慢病毒和腺病毒)的過程效率相對較低。這導致了制造能力不足和成本高昂。在臨床試驗中,一個病人的治療費用高達25萬美元以上。
這些挑戰推遲甚至阻礙了更廣泛地開發可能挽救生命的醫療產品。我們需要的是更有效和標準化的生產過程,以開發基因治療載體。
為此,FDA正在內部采取行動,并通過各種合作伙伴關系,幫助提高生產基因治療載體的細胞系的產量。我們也在采取措施研究先進制造技術的應用,例如連續制造。我們希望幫助提供各種工具,以加快該領域藥物的開發進程。另外,我們正在積極尋求新的投資,以擴大連續制造平臺的使用,這在細胞和基因療法方面尤其重要。我們有一個關于如何擴大連續制造能力的提案,作為我們2019年預算申請的一部分。
需要解決的第二個問題主要是概念上的,盡管涉及到一些技術方面的問題。
細胞和基因療法領域正在使用醫藥行業的生產模式,即早期開發過程中的藥物采用中試生產。一旦早期開發成功,才進行商業化生產工藝開發,用于支持后期臨床開發和最終的市場銷售。
當最終只有十或二十分之一的產品進入市場,并且最終的市場規模是成千上萬或數百萬人的時候,這種模式運行良好,可以節約時間和金錢。我們現在所處的環境是,用臨床試驗證明細胞和基因療法的安全性和有效性,可能只需要幾十個人來證明這些產品是安全有效的。
例如:一種替代缺陷蛋白質的基因療法,改變患者的感受、功能和存活方式。這種基因療法從中式工藝過渡到商業化工藝的需求可能大大拖延產品進入市場,甚至導致放棄開發,因為制造過渡可能代價高昂且困難重重。
我們現在鼓勵生產商,特別是那些針對小規模患者群體的生產商,開發具有內在質量屬性的可擴展的制造工藝,這些過程可能有助于擴大規模和獲得許可。一種技術上可以實現的方法是使用制造"基因盒"為數量有限的個人生產出足夠的產品,比如說10或20個人,這可能足以供應一個初步的臨床試驗。如果產品很有前景,那么進一步的開發和最終完全許可可以簡單使用多個基因盒實現。
或者,可以開發一種連續制造技術,具有足夠的放大能力,以支持從臨床試驗轉向商業生產。我們已經看到一些致力于基因療法產品的開發者開始投資能適應這些連續平臺的技術。
很明顯,這些新技術將改變醫學和人類健康。幾十年前,基因療法在很大程度上還只是一個理論。現在我們不僅可以期望這些產品能夠治愈疾病,而且也應該能夠實現這個目標。這一領域正在迅速發展,FDA的科學家們正積極應對制造業和臨床開發方面的挑戰。
FDA對于從再生醫學聯盟等組織獲得的所有支持表示感謝。通過共同努力,我們有可能治愈曾經被認為無法治療的疾病,給病人帶來新的希望 。
科學家對英國、歐洲和美國的數百人進行DNA檢測,發現了與神經發育障礙(NDD)相關的基因突變。圖片來源:英國《衛報》網站 包括英國曼徹斯特大學、牛津大學科學家在內的國際研究團隊發現了一種基因......
2024年7月9日,uniQure宣布其通過大腦直接注射的在研基因療法AMT-130在治療亨廷頓病(HD)的1/2期臨床試驗中獲得積極中期結果。分析顯示,在24個月時,接受高劑量AMT-130治療HD......
從中國科學院動物研究所獲悉,該所李偉研究員與周琪研究員團隊開發的逆轉座子基因工程新技術,首次實現以RNA為媒介的基因精準寫入,有望為遺傳病、腫瘤等疾病帶來更高效、更安全、更低成本的全新治療方式,為新一......
基因組DNA是生命的藍圖,對基因組DNA實現任意尺度的精準操作代表對生命藍圖進行修改繪制的底層能力,是基因工程技術發展的核心。以CRISPR基因編輯技術為代表的技術進步實現了基因組單堿基和短序列尺度的......
記者9日從中國科學院動物研究所獲悉,該所李偉研究員與周琪研究員團隊開發的逆轉座子基因工程新技術,首次實現以RNA為媒介的基因精準寫入,有望為遺傳病、腫瘤等疾病帶來更高效、更安全、更低成本的全新治療方式......
在近日召開的國務院常務會議上,國務院總理李強主持并審議通過了備受矚目的《全鏈條支持創新藥發展實施方案》。這一舉措對于推動中國生物醫藥領域的創新發展具有深遠影響,尤其是細胞與基因療法行業,有望因此迎來全......
7月3日,中信湘雅生殖與遺傳專科醫院和深圳華大基因科技有限公司簽署戰略合作協議,雙方將共建“中信湘雅-華大DCSlab”科研實驗平臺,推動基因組學、基因檢測、輔助生殖技術及精準醫療等領域的科學研究。簽......
·Intellia在新聞稿中稱,這是顯示體內CRISPR/Cas9基因編輯療法可有效重復給藥的首個臨床數據,表明體內基因編輯重復給藥完成概念驗證。NTLA-2001并無針對轉甲狀腺素蛋白淀粉樣變性的重......
6月27日,國家藥監局黨組成員、副局長徐景和會見印尼食品藥品管理局代理局長、衛生部藥品和醫療器械總司長里茲卡·安達露西亞一行。雙方就藥品醫療器械監管法治建設、產品全生命周期質量監管、監管體系和監管能力......
為推動疫苗國家監管體系建設,持續提升我國疫苗藥品監管能力水平,6月19日至26日,國家藥監局邀請世界衛生組織專家,在昆明舉辦良好監管管理規范(GRP)和監管績效指標(RPI)專題培訓。世界衛生組織總部......