原文地址:http://www.cas.cn/syky/202103/t20210312_4780755.shtml
多巴胺(dopamine,DA)是人體中重要的單胺類神經遞質,參與對中樞神經系統(CNS)及外周神經系統(PNS)多種生理功能的調控。在CNS中,DA介導神經細胞之間的信號傳遞,在大腦獎勵機制、動機產生、欣快感發生及行為調節等生理過程中發揮作用,而在PNS中,DA則主要是作為一種旁分泌信使,參與對血壓、消化系統以及免疫功能等的調控。DA通過人體內的多巴胺受體(dopamine receptors,DRs)進行信號傳遞。DRs家族屬于G蛋白偶聯受體(G protein-coupled receptor, GPCR),包括D1R到D5R共五個受體成員。按照偶聯下游G蛋白種類的不同,這些受體可以進一步分為D1類受體和D2類受體兩組。D1類受體包含D1R和D5R,主要與激活型G蛋白Gs偶聯,刺激下游第二信使環狀單磷酸腺苷(cAMP)的生成,進而影響細胞信號通路和功能。D1R的功能失調和帕金森氏病、精神分裂癥、藥物成癮等神經系統疾病相關,使之成為治療神經精神類疾病藥物研究的重要靶點。
內源性配體DA及其他靶向D1R的合成類激動劑藥物等正性結合配體,通過作用于D1R近胞外區的正性結合口袋激活受體。這些正性激動劑對受體的激活效應可被變構調節劑調節。與正性結合配體相比較,變構調節劑具有更高的GPCR亞型選擇性和功能選擇性等優勢,表現出良好的成藥潛力。正性變構調節劑(positive allosteric modulator,PAM)可增強正性激動劑引起的胞內信號響應,與之起到功能的協同作用。目前,已報道多種D1R PAM,包括CID2886111、DETQ及LY3154207等,然而,這些PAM如何調節D1R構象并促進D1R激動劑活性的分子機制尚不清楚。此外,作為DRs的內源性配體,DA如何識別并激活DRs,這一科學問題未得到闡釋。
前期,中國科學院上海藥物研究所徐華強課題組聯合國內外多家單位,解析并報道了D1R結合選擇性及非選擇性激動劑等多個信號復合體的高分辨率結構,結合多項功能實驗數據,揭示了激活態D1R的配體選擇性以及G蛋白選擇性差異上的結構基礎等分子機制。在此基礎上,徐華強課題組聯合浙江大學教授張巖課題組、美國北卡羅來納大學教堂山分校教授Bryan L. Roth課題組等,對D1R內源性配體DA及正性變構調節劑的結合以及調節機制進行了進一步探索,解析了在PAM LY3154207結合下,內源性配體DA及合成類選擇性激動劑SKF81297分別激活D1R形成的D1R-Gs信號復合體的近原子分辨率結構,并結合突變功能實驗分析,揭示了DA及LY3154207的配體結合口袋拓撲結構特性以及LY3154207對D1R的潛在變構調節機制等,為設計更為合理高效的治療CNS疾病的靶向D1R藥物提供了重要的結構基礎和理論依據。相關研究成果在線發表在Cell Research上。
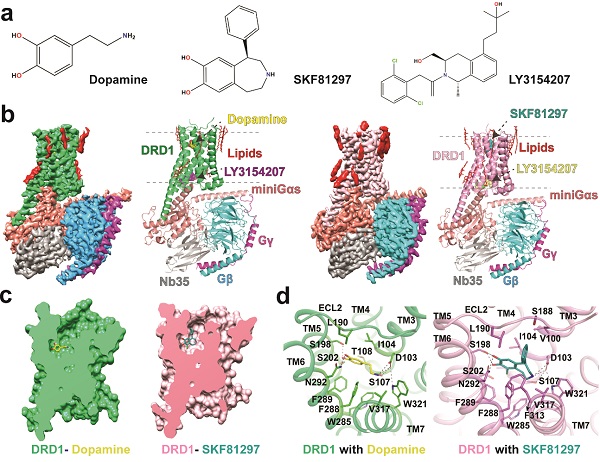
研究發現,DA和SKF81297與D1R的相互作用整體相似,不同的是,DA缺乏與D1R互作的延伸結合口袋(Extended binding pocket,EBP),這使得其對D1R的親和力比SKF81297更弱。此外,研究還發現,在SKF81297結合下,D1R的胞外區loop 2(ECL2)中的D187朝向TM2和TM7的極性氨基酸K81和D314,形成一個潛在的極性相互作用網絡,而這種結構特征在DA結合下D1R的結構中不存在。與此對應的是,D1R-DA的整個近胞外端口袋在拓撲結構上比D1R-SKF81297的結合口袋更為開放,這預示著DA和SKF81297與D1R在結合動力學特性上存在差異。
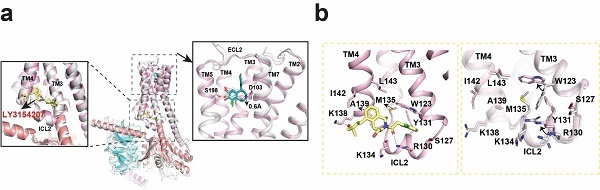
較高分辨率的結構使得PAM LY3154207的結合模式能夠在D1R上清楚地得到展示。LY3154207以船式構象結合到D1R胞內區loop 2(ICL2)的正上方,介于TM3和TM4之間,這一結合模式與β2AR的PAM Cmpd-6FA與β2AR的結合類似。研究中LY3154207的結合模式與先前研究通過計算機分子動力學模擬得出的LY3154207的構象不同。近期,四川大學邵振華團隊等報道了D1R結合LY3154207的結構,然而,研究中LY3154207的結合模式與已報道的D1R結構中的LY3154207的構象也存在顯著區別。對比LY3154207存在以及不存在時D1R-SKF81297的結構發現,D1R-SKF81297-LY3154207結構中正性激動劑SKF81297的結合模式比D1R-SKF81297結構中的深0.6埃,使得其與S198形成更多的氫鍵相互作用。LY3154207結合下SKF81297與D1R能形成更大的極性相互作用網絡,這表明,LY3154207可通過D1R的構象改變促進正性激動劑的結合,從而使得D1R維持在激活態,進而增強正性激動劑的激活效應。
該研究冷凍電鏡數據在上海藥物所冷凍電鏡平臺及浙江大學冷凍電鏡中心收集。上海藥物所為研究工作的第一完成單位,上海藥物所2020屆博士畢業生莊友文、美國北卡羅來納大學教堂山分校Brian. Krumm及浙江大學基礎醫學院博士研究生張會冰為論文的共同第一作者,徐華強、張巖及Bryan L. Roth為論文的共同通訊作者。研究工作獲得上海市市級科技重大專項、國家重點研發計劃、中科院戰略性先導科技專項、國家自然基金委員會、浙江省自然基金委及美國國立衛生研究院等的資助,并得到中科院院士、上海藥物所研究員蔣華良的幫助。
圖1.LY3154207結合下DA-D1R-Gs以及SKF81297-D1R-Gs復合物的結構。a.DA、SKF81297以及LY3154207的化學結構式。b.DA-LY3154207-D1R-Gs及SKF81297-LY3154207-D1R-Gs復合物的冷凍電鏡結構密度圖以及對應的三維結構模型。c-d.DA和SKF81297結合口袋切面圖展示(c)以及兩者與D1R的相互作用(d)
圖2.LY3154207在D1R-Gs復合物中的結合模式(a)及其與D1R的相互作用界面(b)