PCR實驗室產品選擇指南
熒光 基團是吸收一定波長的光子后發射特定波長的光波,可以作為抗體等分子的標記物,實時熒光定量PCR中的Taqman探針常用熒光基團FAM標記熒光基團和TAMRA標記。
熒光基團
吸收特定波長的光子后熒光染料(通常稱為“熒光基團”或簡稱為“熒光素”)的化學鍵即被活化,其化學鍵活化的結果是發射波長更長的光子(能量更低)同時染料分子轉變為基態。
經常使用小的、化學穩定性好的熒光基團作為抗體和其他生物分子的標簽或標記物,這樣的熒光基團一般應具有合適的、高效的(強烈的)激發和發射波長范圍。可以修飾熒光基團分子使其能夠共價地連接到蛋白、核酸和其他生物分子上。
熒光標記的(熒光的)探針廣泛地應用于通過熒光顯微鏡 、流式細胞技術或其他熒光讀取設備檢測蛋白。

熒光素異硫氰酸酯(fit C)的結構
這種廣泛使用的熒光素衍生物染料含有三個環狀結構,此結構賦予該分子熒光特性。對熒光素復合物的修飾是加入了異硫氰酸酯基團,通過該基團可以實現與抗體及其他含有氨基的探針的共價連接。
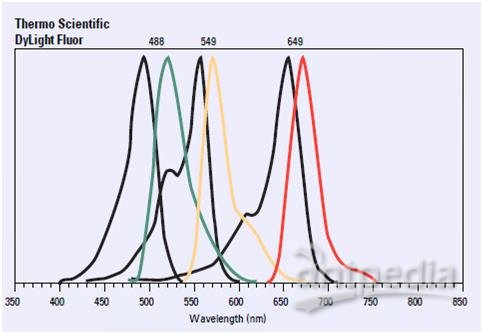
綠色、黃色和紅色熒光染料的激發和發射光譜。DyLight488、549和649是替代熒光素(綠色), 羅丹明 (紅色)和其他傳統熒光染料的高強度、光穩定性好的熒光染料。我們提供標記的二抗和鏈親和素偶聯物,還提供用于標記其他蛋白的同氨基、巰基反應的這些熒光素衍生物。
熒光標記
熒光標記是將熒光基團共價連接到蛋白、核酸等分子上的過程。通常使用能夠選擇性地與目標分子上存在的功能基團反應的熒光素基團衍生物來完成這樣的過程。最常見的標記過的分子是抗體,經常使用標記過的抗體來檢測特定的目標分子。
可在多種檢測系統中使用熒光標記來實現靈敏和定量的檢測。經常使用具有化學反應活性的熒光基團衍生物來實現熒光標記。通常的反應活性基團包括與氨基反應的異硫氰酸酯衍生物,如FITC和TRITC(熒光素和羅丹明的衍生物);和氨基反應的琥珀酰亞胺酯,如NHS-熒光素或NHS-羅丹明;以及和巰基反應的馬來酰亞胺活化的熒光素,如熒光素-5-馬來酰亞胺。
這些具有反應活性的染料與其他分子進行反應會在熒光基團和標記的分子之間形成穩定的共價鍵。長久以來一直將異硫氰酸酯作為連接熒光染料和蛋白賴氨酸側鏈上的伯胺的首選化合物,但是該化合物仍存在一些缺點。
目前的標記方法中多選擇NHS-酯化合物,這是由于該化合物具有針對伯胺的更高特異性并且能夠形成更穩定的連接。與巰基反應的化合物在蛋白質標記的化合物中占有一小部分,經常在需要保存賴氨酸殘基或者需要特異在蛋白上的半胱氨酸殘基上標記熒光染料時使用這種化合物。
在熒光標記反應之后經常需要從標記過的靶分子中去除未反應的熒光基團。通常根據熒光基團與標記的蛋白或者核酸等分子之間的分子量差距,通過分子篩來去除未反應的熒光基團。
然而,很多熒光基團會與許多傳統的分離介質產生相互作用從而導致分離和回收的效率很低。因此優選的染料去除柱是根據熒光染料的疏水特性而設計的。
熒光染料的選擇
生命科學研究中使用的一些基于熒光的系統中經常使用熒光蛋白(例如,藻紅蛋白)或生物發光報告系統。然而,這些技術非常耗時而且無法檢測多個目標,同時與合成的熒光染料相比其靈敏度及光穩定性都不夠好。
使用熒光染料標記的特異性探針的熒光技術能夠在基于細胞的應用中檢測多個目標,并且與多種熒光設備兼容。雖然在生物學應用中熒光素、羅丹明及AMCA染料已經使用了很長時間,但是這些染料仍然有其局限性。
最值得注意的是由于這些傳統染料的熒光強度較低,因此限制了大多數應用的靈敏性;另外由于這些染料易被光漂白,因此限制了通常應用的靈敏度,并且限制了共聚焦顯微鏡應用中的景深及時差顯微技術中的曝光。新一代的熒光基團可以超越這些傳統的染料的限制。
Thermo ScientificDyLight熒光素在亮度、光穩定性以及pH靈敏性等方面都有極大的提高。除了這些優點以外,新一代的熒光基團還能夠覆蓋全部的可見光譜及大部分紅外光譜。
熒光標記應用實例:實時定量PCR技術綜述(原理、熒光標記、TaqMan Probes和Hybridization Probes)
一.實時定量PCR基本原理
1.PCR反應動力學
右圖為PCR反應曲線(橫坐標為循環數,縱坐標表征產物量),不同的曲線代表初始模板量不同的 PCR反應。PCR反應的動力學公式為:
Cn=C0(1+E)n
其中C0和Cn分別為初始模板和n循環的拷貝數,n為循環數,E為擴增效率(0≤E≤1),理想狀態下(即每個循環中所有模板均與引物結合并等到擴增),E為1。

由上圖可知,只有在線性區段E值才為定值,這樣才能通過檢測Cn定量C0,由于終點檢測不能保證在線性區段,所以重復性不好,實時檢測(每個循環檢測一次)技術解決了這個問題。
2.定量PCR原理

定量PCR是將待測標本與一系列濃度(C0)已知的標準品在同一條件下共同擴增,并進行實時檢測,根據標準品的檢測值及已知的C0值作出標準曲線,如右圖(橫作標為的C0對數值),再根據待測標本的檢測值在標準曲線上查到待測標本的C0值。
3.信號產生
目前定量PCR技術信號產生都是基于 FRET (fluorescence resonance energy transfer)的原理,即在一定波長的光激發下,一個熒光基團A發光,并且被鄰近的另一個熒光基團B吸收,使熒光基團B發光。如檢測熒光基團A,應在FRET消除后;如檢測B,則應在FRET發生時檢測。
根據信號產生方式的不同可將定量PCR技術分為三類:TaqMan Probes技術;Hybridization Probes技術;Molecular Beacons技術。
TaqMan Probes技術(右圖A)是Perkin

Elmer公司1995年研制,利用熱穩定DNA聚合酶5’→3’外切酶活性,將TaqMan 探針 5’端熒光基團切去,使之與3’端熒光基團分離、熒光淬滅消失,在特定波長下檢測5’端熒光基團即可表征PCR產物的量。
Hybridization Probes技術(右圖B)是Roche公司建立的,PCR反應退火過程中,兩個探針與模板雜交(相鄰一個堿基),發生FRET,這時檢測第二個熒光基團即可表征PCR產物的量。Hybridization Probes技術要求熱穩定DNA 聚合酶不具備5’→3’外切酶活性,而是在引物延伸過程中被取代,使探針可在下一循環再與模板雜交,如探針被降解,可導致定量不準。
Molecular Beacons技術(上圖C)利用莖環結構的探針,當形成莖環結構時,發生熒光淬滅,退火過程中,探針與模板雜交,熒光淬滅消失,在特定波長下檢測5’端熒光基團即可表征PCR產物的量。
二.熒光標記
1.TaqMan Probes
TaqMan探針通常在5’端以熒光基團FAM標記,靠近 3’端以熒光基團TAMRA標記,3’端磷酸化以防止探針在PCR擴增過程中被延伸。下表列出了兩種熒光基團的吸收及發射波長。
| FAM | TAMRA | |
| 吸收波長 | 492 | 547 |
| 發射波長 | 518 | 573 |
2.Hybridization Probes
Hybridization探針技術中,上游donor Probe 3’端以熒光基團Fluorescein標記;下游acceptor Probe 5’端以Roche的LC-Red 640標記(當用雙熒光基團時還可同時使用LC-Red 705),3’端磷酸化以防止探針在PCR擴增過程中被延伸。也有文獻報道acceptor Probe 5’端以Cy5標記,下表列出了各種熒光基團的吸收及發射波長。
| Fluorescein | LC-Red 640 | LC-Red 705 | Cy5 | |
| 吸收波長 | 494 | 625 | 685 | 643 |
| 發射波長 | 519 | 640 | 705 | 667 |
3.熒光標記基團與PCR儀的激發與檢測波長
由于熒光標記基團的選擇還受到定量PCR儀所提供的激發和檢測波長的制約,所以這里介紹一下臨床應用中主流機型所提供的檢測波長,見下表。
| GeneAmp 5700SDS | ABI Prism7700(適用于科研) | LightCycler | |
| 檢測波長 | 530nm | 500-660nm | 530nm;640nm;705nm |
三.TaqMan Probes技術要點

TaqMan Probes技術要求所用的熱穩定DNA聚合酶不但要具有5’→3’外切酶活性,而且要求所獲得的擴增曲線符合PCR反應動力學。
Matthew J.Longley等(1990)研究了熱穩定DNA聚合酶的5’→3’外切酶活性,認為:(1)其5’→3’外切酶活性和DNA聚合酶活性位于同一肽段;(2)5’→3’外切酶活性依賴于雙鏈DNA(如右圖);(3)5’→3’外切酶活性具有熱穩定性,之所以70℃較50℃活性低(如右圖)是由于高溫破壞了探針與模板間的雙鏈結構。
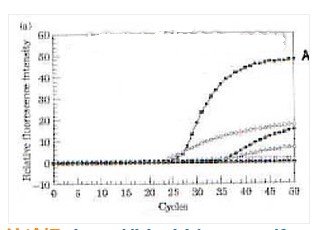
K-A.Kreuzer等(2000)研究了15種熱穩定DNA聚合酶(商品)的5’→3’外切酶活性,其中7種聲稱具有5’→3’外切酶活性,右圖是這7種酶的定量PCR反應(TaqMan)曲線,其中部分酶沒有5’→3’外切酶活性、部分酶具有較弱的5’→3’ 外切酶活性、只有一種酶的擴增曲線(A)符合PCR反應動力學。
下表列出了部分文獻報道的TaqMan Probes技術所使用的酶和其它相關參數。
| Target | P1 | P2 | Probe | Enzyme | 退火溫度 | 延伸溫度 |
| HCV | 19 | 25 | 27 | AmpliTaq DNA polymerase | 60℃ | 60℃ |
| HIV | 19 | 22 | 32 | AmpliTaq Gold polymerase(Perkin-Elmer) | 60℃ | 60℃ |
| Albumin | 22 | 22 | 26 | AmpliTaq Gold polymerase(Perkin-Elmer) | 65℃ | 65℃ |
| 16S rRNA | 27 | 26 | 28 | Taq DNA polymerase | 62℃ | 62℃ |
| gB gene | 18 | 18 | 27 | AmpliTaq Gold polymerase (Perkin-Elmer) | 58℃ | 58℃ |
| omlA | 22 | 22 | 21 | AmpliTaq Gold polymerase (Perkin-Elmer) | 62℃ | 62℃ |
| lytA | 21 | 21 | 25 | Taq DNA polymerase | 60℃ | 60℃ |
四.Hybridization Probes技術要點
Hybridization探針技術要求所用的熱穩定 DNA聚合酶沒有5’→3’外切酶活性,以保證探針有恒定的濃度并能反復與模板雜交。
Jochen,Wilhelm等(2001)研究了Taq酶 5’→3’外切酶活性對基于Hybridization探針技術的定量PCR的影響,認為:
(1)Taq酶5’→3’外切酶活性降解了部分探針;
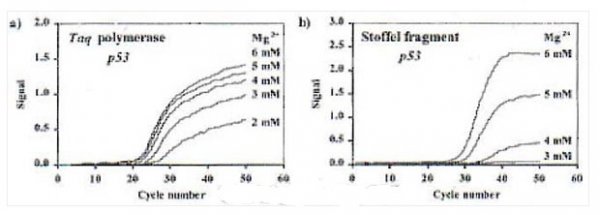
(2)Taq酶的stoffel片段(去除N端289個氨基酸)不具有5’→3’外切酶活性,其在高濃度Mg2+存在下,能獲得較好的PCR動力學曲線(如下圖);(3)stoffel片段因高Mg2+濃度造成的非特異性擴增可采用加入TaqStart antibody的方式消除。
五.TaqMan 探針與Hybridization探針技術的比較
1. Hybridization探針技術的特異性高于TaqMan探針,因其信號的產生依賴于兩個獨立探針的特異性。但其在探針設計上需要更多的可選序列;
2. TaqMan探針技術的開放性優于Hybridization探針技術,原因有二:
(1)TaqMan探針技術的熒光標記系統是開放的,易從第三方獲得,而Hybridization探針的熒光染料為羅氏專有,易受其控制;
(2)TaqMan探針和Hybridization探針分別在ABI Prism7700和羅氏LightCycler上建立,因熒光標記和儀器檢測波長的不同,限制了其在兩種儀器上的通用性,目前已有文獻報道將 TaqMan探針用在LightCycler上,但未見報道Hybridization探針用在ABI Prism7700上,可能是ABI Prism7700價格較貴,不適合臨床應用,而ABI GeneAmp 5700SDS只有一個檢測波長(530nm);也可能Hybridization探針依賴于LightCycler的快速擴增。
3. Hybridization 探針分別標記兩個探針,和TaqMan探針的同一探針三種修飾相比,修飾技術要求低,對修飾的質量控制更有利。
實時熒光定量PCR技術科根據信號產生的不同,可以分為TaqMan Probes、Hybridization Probes、Molecular Beacons三類,其中Taqman探針常用5‘熒光基團FAM標記和3‘熒光基團和TAMRA標記,Hybridization Pro常用熒光基團Fluorescein標標記 3’端,常用Roche的LC-Red 640標記標記5'端。
2019年11月5日,華東理工大學生物反應器工程國家重點實驗室楊弋教授等在NatureBiotechnology(《自然—生物技術》)雜志上發表了封面學術論文,題為“VisualizingRNAdyn......
光激勵發光材料可將短波長的激發光能量儲存在基質陷阱中,并在長波光子如近紅外光的激勵下發射短波光子,在輻射劑量計、紅外成像、信息存儲和發光涂料等技術領域具有廣泛的應用。由于近紅外光具有深層生物組織穿透、......
λ噬菌體是最常見的一種感染大腸桿菌的溫和噬菌體,稱為生物界的氫原子,它典型的調控機制使其成為生物學家研究基因調控及細胞分化最優異的模型。互相抑制的轉錄因子CI和Cro的相互作用決定了細胞的命運(即細胞......
華東理工大學和中科院上海藥物所的一項最新合作研究為細胞的靶向、精準功能標記研究提供了新的光可控化學探針工具。相關研究成果日前在線發表于《自然-通訊》。可靶向、精準探測不同細胞生命和疾病過程的熒光探針技......
小鼠腸道感覺細胞通過血清素直接與腸道神經元進行對話,讓大腦知道某些化合物是否存在。這些腸道細胞將腸道的內含物告訴大腦。但是對這種腸道-大腦對話的分子機制的認識因技術限制受到阻礙。如今,在一項新的研究中......
生物通報道:美國當地時間2016年8月24日,華裔諾貝爾化學家得主錢永健(RogerY.Tsien)去世,享年64歲,他曾幫助科學家看到了以前從未想象過的東西。相關閱讀:Nature新聞:錢永健——他......
2013年11月23日-25日,2013年全國無機及同位素質譜學學術會議在江蘇昆山召開,23日下午清華大學教授張新榮教授做題為《ICP-MS在生命科學分析中的應用潛力》的報告,為從事ICP-MS原子光......
近日,中科院武漢病毒研究所王漢中領導的研究團隊在納米材料標記囊膜病毒示蹤方面取得重要研究進展,相關文章發表于美國化學會刊物ACSnano(IF:11.421)上。病毒侵染機制的研究是病毒學研究中最基本......
對于大多數生物學過程來說,所見即所得。由于病毒在感染性疾病中的作用,許多生物學家希望能夠實時觀察病毒的活動。要觀察病毒感染細胞和病毒裝配的過程,熒光成像是少數幾種非介入性的途徑之一。進行這樣的研究需要......
據物理學家組織網近日報道,美國佐治亞大學的科研人員采用專門設計的納米材料,開發出了無標記的新型DNA和RNA檢測方法,有望降低常用基因檢測技術的成本和復雜性。相關研究報告發表在近期出版的《美國化學學會......