實驗概要
采用浸入法將蛋白質從凝膠轉移至硝酸纖維素膜是先將凝膠緊貼于一塊硝酸纖維素膜,然后再將這種夾層組合浸入盛有大量緩沖液的轉印槽內,使電流從轉印槽的一側通向另一側。通過電洗脫的方法可將蛋白質從凝膠中轉印至濾膜上,如同在凝膠中遷移,只不過移動方向與膠平面垂直。若操作仔細,這是一種可將許多蛋白質轉印至膜上非常有效的方法。此法比半干法稍微費時,也需用較多的緩沖液,但它更為簡便。
但對浸入式轉印,尚無一組條件能將各種蛋白質完全、均勻地轉印并較好保持于膜上。根據待轉印蛋白質的分子質量,可選用2種緩沖液中的1種,并根據經驗確定不同的轉印時間。以下列舉的時間可作為參考。
主要試劑
硝酸纖維素濾膜
吸水濾紙(Whatman 3MM或替代物)
蒸餾水
轉印緩沖液1(蛋白質為20 000-400 000kDa:0.1%(w/v)SDS、20%甲醇溶于50mmol/LTris堿和380mmol/L甘氨酸[無pH值])
或轉印緩沖液2(蛋白質<80 000kDa):20%甲醇、25mmol/LTris堿和190mmol/L甘氨酸(無pH值)
考馬斯亮藍染色液
主要設備
浸入式轉印裝置
實驗步驟
1. 將凝膠切成所需大小用于轉印。除去無關凝膠和未使用的凝膠泳道。將凝膠做好標記以確定第一條泳道的去向(一般是剪去凝膠底部左手邊角即可)。在準備濾紙時,將疑膠放入轉印緩沖液中。
2. 剪取1張硝酸纖維素膜和4張吸水紙(Whtaman 3 MM或替代物),使其大小與凝膠相同。操作時戴手套并使用新的硝酸纖維素膜。蛋白質與硝酸纖維素膜的結合鍵型尚不清楚,但油污或其他蛋白質可阻礙此種結合。
3. 將硝酸纖維素膜浸入蒸餾水中。通常是小心地將硝酸纖維素膜放在水面上使其浸濕。通過毛細管作用從底部開始浸濕硝酸纖維素膜(數分鐘),然后將膜浸入水中2min。再放入轉印緩沖液中5min。將吸水紙放入轉印緩沖液中浸濕。
1) 轉印緩沖液1(蛋白質為20 000-400 000kDa)的配制(1000ml濃度)
Tris堿 48mmol/L 5.8g
甘氨酸 390mmol/L 29.3g
SDS 0.1%(v/v) 1.0g
甲醇 20% 200ml
蒸餾水加至1000ml
2) 轉印緩沖液2(蛋白質<80 000kDa)的配制(1000ml濃度)
Tris堿 25mmol/L 3.0g
甘氨酸 190mmol/L 14.5g
甲醇 20% 200ml
蒸餾水加至1000ml
4. 將凝膠、硝酸纖維素膜、濾紙和支持墊浸入緩沖液中并保證其完全浸泡。小心地將支持墊中的氣泡趕出。
5. 將轉印夾層組合按圖進行安裝。使所有的部分保持濕潤,務必使凝膠和濾紙之間接觸良好。
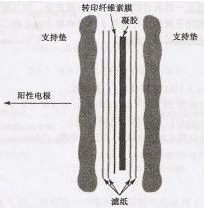
6. 將轉印夾層組合放入轉印槽中,硝酸纖維素膜緊靠正極(陽極,紅色電極)。
7. 轉印4~18h。較厚的凝膠和分子質量較大的蛋白質需要較長的轉印時間。可對下述條件進行優化使分子質量范圍很廣泛的蛋白質都得到轉印。
對于375pxXl125pxX2.5px大小的凝膠,分子質量超過100 000kDa的蛋白質,可先用28V轉印1h,然后于84V轉印14~16h。若蛋白質的分子質量低于100 000kDa,則以63V轉印4-16h即可。
在轉印過程中,溫度會明顯升高。因此,需要使用冷卻管或在低溫室內進行轉印以避免在夾層組合中產生氣泡。
8. 轉印結束后立即斷開電源。小心拆開裝置。在膜上做好標記(一般剪去底部左手邊角,并定為第一泳道)。
9. 用考馬斯亮藍對凝膠進行染色或銀染以驗證轉印物。硝酸纖維素膜經過適當處理后進行染色或封閉。
附 件 (共1個附件,占11KB)
1.jpg
11KB 查看