在2024年2月期間,國家藥品監督管理局、醫療器械技術審評中心、國家衛生健康委員會、國家組織醫用耗材聯合采購平臺以及國家標準化管理委員會等多部門,共同或分別出臺了一系列關于醫療器械行業的政策法規文件。這些公告和通知涉及了包括創新醫療器械優先審批程序在內的多個重要議題,旨在進一步規范醫療器械市場秩序,推動技術創新與應用,加強產品質量監管,并促進醫用耗材集中采購工作的深化實施。同時,各地監管部門也相應發布了配套措施及指導性意見,以確保相關政策的落地執行。
發布機構 | 日期 | 相關文件 |
國家藥監局 | 2月1日 | 《中國醫療器械標準管理年報(2023年度) 》 |
2月5日 | 《2023年度醫療器械注冊工作報告》 | |
2月19日 | YY1001-2024《全玻璃注射器》等20項醫療器械行業標準 | |
國家衛健委 | 2月8日 | 《關于2023年甲類大型醫用設備配置許可結果的通告》 |
2月8日 | 《國家衛生健康委關于調整"十四五"大型醫用設備配置規劃的通知》 | |
國家藥監局器審中心 | 2月5日 | 《關于調整醫療器械注冊電子申報信息化系統業務范圍的通告》 |
2月6日 | 醫療器械優先審批申請審核結果公示 | |
2月6日 | 《近視弱視用激光設備技術審評要點》 | |
2月6日 | 正電子發射磁共振成像系統等4項醫療器械產品注冊審查指導原則 | |
2月7日 | 創新醫療器械特別審查申請審查結果公示 | |
2月28日 | 2024年1月醫療器械技術審評工作情況匯總 | |
2月28日 | 2024 年1月審結轉出注冊項目審評用時情況 | |
國家組織醫用耗材聯合采購平臺 | 2月5日 | 關于開展人工關節類醫用耗材信息集中維護工作的通知 |
2月23日 | 人工關節集中帶量采購協議期滿接續采購公告(第1號) | |
2月26日 | 關于公示人工關節部件信息的通知 | |
國家標管中心 | 2月19日 | 《2024年全國標準化工作要點》 |
北京市藥監局 | 2月1日 | 北京市創新醫療器械產品公示 |
重慶市藥監局 | 2月6日 | 重慶市藥品監督管理局2023年第一類醫療器械產品備案管理工作綜述 |
天津市藥監局 | 2月19日 | 天津市第二類創新醫療器械審查認定公示 |
吉林省藥監局 | 2月27日 | 關于推進第二第三類高端醫療器械裝備項目研發成果轉化的通知 |
廣東省藥監局 | 2月21日 | 創新醫療器械特別審批(廣東省第二類) |
陜西省藥監局 | 2月1日 | 《陜西省醫療器械生產質量信用等級評定及分類監督管理辦法》 |
1、2月1日:《中國醫療器械標準管理年報(2023年度)》
截至2023年12月31日,我國現行有效醫療器械標準共計1974項,其中國家標準271項,行業標準1703項。
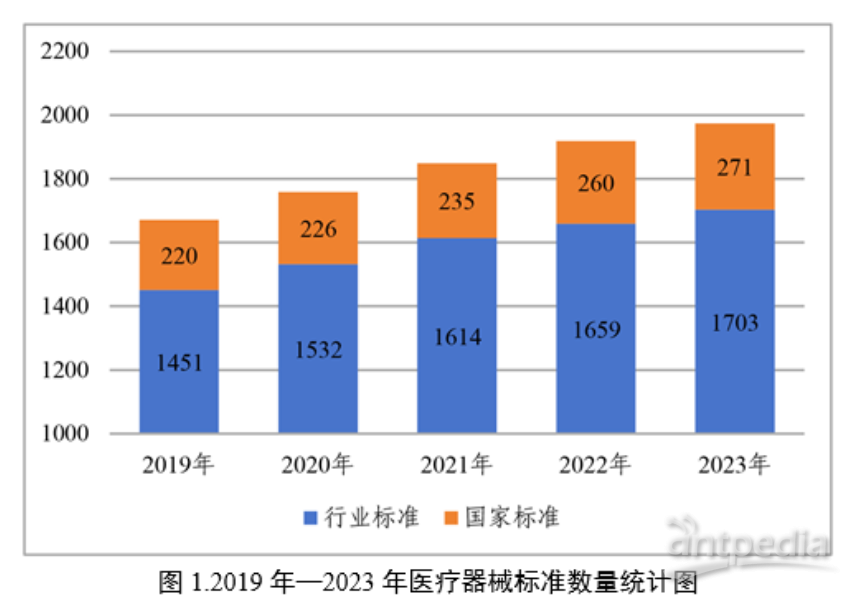
2、2月5日:《2023年度醫療器械注冊工作報告》
2023年,國家藥監局依職責共受理醫療器械首次注冊、延續注冊和變更注冊申請共計13260項,與2022年相比增加25.4%。

3、2月19日:YY 1001—2024《全玻璃注射器》等20項醫療器械行業標準
4、2月8日:《關于2023年甲類大型醫用設備配置許可結果的通告》
重離子質子放射治療系統準予許可名單及高端放射治療類設備準予許可名單。
5、2月8日:《國家衛生健康委關于調整“十四五”大型醫用設備配置規劃的通知》
“十四五”期間,全國重離子質子放射治療系統配置規劃數新增8臺(套),專門用于社會辦醫療機構,分年度實施,準入標準不變。

6、2月5日:《關于調整醫療器械注冊電子申報信息化系統業務范圍的通告(2024年第7號)》
為進一步指導注冊申請人準備電子版資料,我中心制作了自行撤回醫療器械注冊申請申報資料電子目錄文件夾結構,現予發布。
7、2月6日:醫療器械優先審批申請審核結果公示(2024年第2號)
8、2月6日:《近視弱視用激光設備技術審評要點》
為進一步規范近視弱視用激光設備的管理,國家藥監局器審中心組織制訂了《近視弱視用激光設備技術審評要點》。
9、2月6日:發布正電子發射磁共振成像系統等4項醫療器械產品注冊審查指導原則
為規范部分有源產品的注冊申報和技術審評,國家藥監局器審中心組織制修定了《正電子發射磁共振成像系統注冊審查指導原則》等4項注冊審查指導原則。
10、2月7日:創新醫療器械特別審查申請審查結果公示(2024年第2號)
2024年,國家藥品監督管理局醫療器械技術審評中心依據《創新醫療器械特別審查程序》的相關規定,對近期提交的創新醫療器械特別審查申請進行了嚴謹、公正且高效的審查,并于同年第2號公示中正式發布了審查結果。
6、2月28日:2024年1月醫療器械技術審評工作情況匯總
2024年1月,國家藥監局器械審評中心完成了對多款醫療器械產品的嚴格技術審評,并在當月批準注冊了321個醫療器械產品。廣東等地方局亦核發新的生產許可證。同時,創新醫療器械特別審查程序持續進行,盡管1月份具體審查結果未明確公示,但相關部門保持高效運作,不斷推進新品審批及企業許可管理,體現了監管部門對產品質量安全與技術創新的重視。
7、2月28日:2024年1月審結轉出注冊項目審評用時情況
8、2月,國家組織醫用耗材聯合采購平臺發布多個文件,正式啟動人工關節國采續標工作。
9、2月19日:《2024年全國標準化工作要點》
10、北京市藥監局
2月1日:北京市創新醫療器械產品公示 (2024年第一期)(2024年第二期)
11、重慶市藥監局
2月6日:重慶市藥品監督管理局2023年第一類醫療器械產品備案管理工作綜述
全年共辦結第一類醫療器械備案365個,備案變更176個,不予備案50個,取消備案70個。
12、天津市藥監局
2月19日:天津市第二類創新醫療器械審查認定公示(2024年第1期)
13、吉林省藥監局
2月27日:關于推進第二第三類高端醫療器械裝備項目研發成果轉化的通知
14、廣東省藥監局
2月21日:創新醫療器械特別審批(廣東省第二類)
15、陜西省藥監局
2月1日:《陜西省醫療器械生產質量信用等級評定及分類監督管理辦法》
在2024年2月期間,國家藥品監督管理局、醫療器械技術審評中心、國家衛生健康委員會、國家組織醫用耗材聯合采購平臺以及國家標準化管理委員會等多部門,共同或分別出臺了一系列關于醫療器械行業的政策法規文件。......
在2024年2月期間,國家藥品監督管理局、醫療器械技術審評中心、國家衛生健康委員會、國家組織醫用耗材聯合采購平臺以及國家標準化管理委員會等多部門,共同或分別出臺了一系列關于醫療器械行業的政策法規文件。......
商務部發布的最新數據顯示,1月份,全國新設立外商投資企業4588家,同比增長74.4%;實際使用外資金額1127.1億元人民幣,同比下降11.7%,環比增長20.4%。商務部外資司負責人表示,2023......
近日,廣東省醫療器械管理學會發布關于征集《重組人源纖連蛋白》團體標準起草單位的通知。各醫療器械行業相關單位:為貫徹落實《國務院關于印發深化標準化工作改革方案的通知》(國發辦(2015)13號》,進一步......
近期,安圖生物先后獲國家藥品監督管理局、河南省藥品監督管理局頒發的新型冠狀病毒(2019-nCoV)抗原檢測試劑盒(磁微粒化學發光法)、抗線粒體M2抗體IgG檢測試劑盒(磁微粒化學發光法)、人CYP2......
2023年年底,MedtechInsight發布了2024全球醫療器械100強榜單,對全球頭部醫療器械企業從多個不同維度進行了排名,其中也包括IVD。本文數據主要來自MedtechInsight,只對......
近日,艾立本科技旗下全資子公司立本醫療器械(成都)有限公司自主研發的“人體呼出氣檢測質譜儀(Breath-TOFMS2000)”正式獲得四川省藥品監督管理局頒發的《中華人民共和國醫療器械注冊證》(注冊......
2月19日,國家藥監局審定通過了有關YY/T1740.3—2024醫用質譜儀第3部分:電感耦合等離子體質譜儀等20項醫療器械行業標準(具體見文末附件)。YY/T1740.3—2024醫用質譜儀第3部分......
博濟醫藥2月19日公告,公司與江蘇諾泰澳賽諾生物制藥股份有限公司簽訂了《技術服務(委托)合同》,合同總金額為人民幣1.08億元(含稅)。合同約定諾泰生物委托博濟醫藥提供“司美格魯肽注射液”臨床研究服務......
國家藥監局關于發布YY1001—2024《全玻璃注射器》等20項醫療器械行業標準已經審定通過,現予以公布。標準編號、名稱、適用范圍及實施日期見附件。特此公告。國家藥監局2024年2月7日醫療器械行業標......