一、前言
幾十年來癌癥的治療一直受到了科學家的極大關注。乳腺癌的治療在過去20年內得到了極大程度的發展,雖然該疾病的死亡率大幅度降低,但該疾病的發病率仍然非常高。在各類乳腺癌中,“三陰性乳腺癌”因為缺少治療靶標(如雌激素受體、孕酮受體和人表皮生長因子受體2),一直是治療的難點。令科學家感興趣的是:“三陰性乳腺癌”腫瘤里具有最多的腫瘤浸潤性淋巴細胞,這些淋巴細胞被推測有助于抵抗腫瘤生長,然而三陰性乳腺癌會使腫瘤中的淋巴細胞沉默或失活。這也給我們一個提示,對于三陰性乳腺癌,如果我們使用免疫治療方法激活殺傷腫瘤的淋巴細胞活性,將會是一個新的治療策略。
二、什么是免疫抑制機制
該講座先介紹了最重要的一種免疫抑制機制,即“PD-L1和PD-1作用機制”。癌細胞在細胞表面表達PD-L1,PD-L1將會鏈接T細胞的PD1,這種關聯將最終關閉T細胞的活性,也就是發生“免疫逃逸”。科學家現在開發了單克隆抗體,可以專一性地識別癌細胞上的PD-L1或T細胞上的PD-1。這種策略將有助于掩蓋這兩種分子的相互作用的表面,因此可以阻斷PD-L1和PD-1的鏈接,從而重新激活T細胞的活性,允許T細胞識別癌細胞,然后清除這些它們。目前,這類治療的整體響應率在大概20%-40%。演講者判斷“三陰性乳腺癌”一定存在類似的免疫抑制機制。
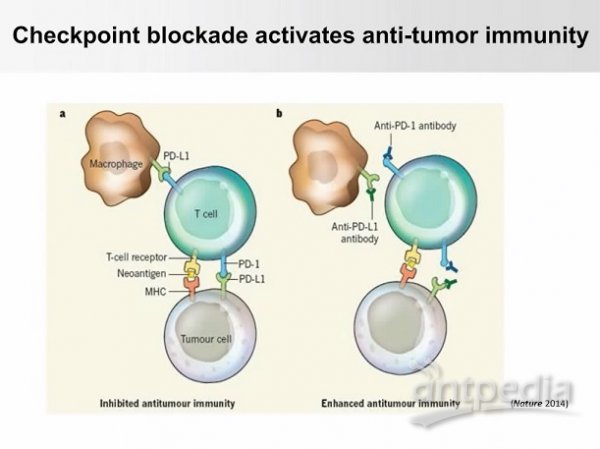
圖1.PD-L1和PD-1作用機制
本講座通過研究三陰性乳腺癌細胞的PD-L1的糖基化和穩定性,探索了用單克隆抗體阻斷“免疫逃逸”的機制,及研發出新的“抗體和藥物結合物(ADC)”來治療三陰性乳腺癌。
三、實驗方法及結果
演講者先研究了癌細胞上的PD-L1,想弄明白PD-L1表達在癌細胞的哪個部位?因為PD-L1的分子量為33千道爾頓,而Western Blot實驗表明,33千道爾頓的蛋白質表達是非常少的,而50千道爾頓的蛋白質表達非常多。經過一系列的基因敲除實驗,證實這個高分子量的蛋白就是PD-L1信號,是高度糖基化的PD-L1。用突變方法發現PD-L1只在其細胞外區域的4個NXT結構域上發生了糖基化。
為了驗證糖基化的PD-L1和PD-1的相互作用,演講者使用IncuCyte活細胞動態成像系統對PD-L1和PD-1之間的動態變化進行定量。向有糖基化PD-L1的癌細胞(紅色核標記)溶液中加入綠色熒光標記的PD-1蛋白質,在處理后12個小時的時候,細胞表面有大量的綠色聚集,說明PD-L1和PD-1有相互作用。而對于非糖基化的PD-L1的穩定克隆,并沒有看到很多的綠色熒光,這意味著PD-L1和PD-1在12個小時之后沒有相互作用。結果顯示這個糖基化結構是蛋白相互作用所必須的。

圖2.用IncuCyte成像儀對PD-L1和PD-1之間的動態變化進行定量
為了理解糖基化的功能,演講者再次使用IncuCyte成像儀來模擬T細胞存在時癌細胞和T細胞的動態相互作用。在此例中,對于BT549核IP細胞,加入活化的T細胞,共同孵育5天時間,用表示Caspase 3活性的綠色熒光表示癌細胞的凋亡。只要癌細胞開始死亡,就可以看到紅色熒光的減弱和綠色熒光的增強。結果表明:糖基化PD-L1的癌細胞對T細胞殺傷具有抵抗作用,而非糖基化的癌細胞對T細胞殺傷非常敏感。

圖3.用IncuCyte成像儀來模擬T細胞存在時癌細胞和T細胞的動態相互作用
下一步,演講者想了解調控糖基化的上游信號是什么?他們將兩種三陰性乳腺癌細胞BT549和BT468,用不同的刺激物,如EGF,IGF,HGF,FGF和TGFβ處理。發現EGF可以一致地誘導兩種三陰性乳腺癌細胞的PD-L1的糖基化。糖基化的PD-L1很穩定,而非糖基化的PD-L1半衰期很短。上游信號EGF,可以增加PD-L1的糖基化形式。所以如果我們抑制EGFR信號,我們就可以使同源動物模型中的三陰性乳腺癌細胞對“抗-PD-1”的治療敏感。
另一個發現是:三陰性也會誘發慢性的炎癥。他們想了解為什么這些炎癥會引起癌癥的發展。演講者發現,在腫瘤微環境中,巨噬細胞具有分泌TNFα(腫瘤壞死因子α)的能力,而TNFα會識別癌細胞的TNFα受體。TNFα將活化NF-kappaB,并且引起p65的核轉移,然后開啟CSN5的表達。CSN5是一種泛素化酶,該酶將穩定PD-L1,誘導癌細胞的免疫抑制功能,促進癌細胞的發展。
演講者與藥廠合作,開發抗糖基化PD-L1的抗體。他們將糖基化的PD-L1作為抗原接種在小鼠上,創造了3,000個雜交瘤克隆。然后用流式細胞儀篩選這3,000個克隆,努力尋找能特異性識別糖基化PD-L1,而不識別非糖基化PD-L1的抗體。然后用IncuCyte成像儀進一步揭示哪個抗體具有阻斷PD-L1和PD-1相互作用的功能。他們使用了Essen BioScience的技術和pHrodo吞噬系統,來研究抗體是否能結合糖基化的PD-L1,然后誘導這個PD-L1的內部化,并進入溶酶體被細胞降解。演講者將STM108抗體用熒光染料標記上熒光。當細胞開始吞噬這些抗體時,IncuCyte成像儀中將會觀察到紅色熒光。在此例中,當他們將STM108抗體加入PT549的穩定克隆中時,可以看到在12個小時的過程中能誘導出很漂亮的紅色熒光,暗示STM108抗體可以特異性地內化到癌細胞中去。然后在處理5天之后做了Western Blot,可以發現大量的PD-L1減少了,暗示PD-L1發生了降解。

圖4.用IncuCyte成像儀觀察pHrodo吞噬系統,暗示STM108抗體可以特異性地內化到癌細胞中去。
演講者又研究了抗體和藥物結合技術,挑選MMAE作為彈頭,將細胞毒性的藥物結合到抗體上。當小鼠具有PD-L1表達,用“抗體藥物結合物(ADC)”處理之后,它們的腫瘤生長發生了顯著降低。當用糖基化ADC抗體處理之后,4T1-hPDL1腫瘤也不再生長。當小鼠用糖基化的MMAE抗體處理后,可觀察到腫瘤微環境中產生強烈的紅色熒光,表示Caspase 3的活性增加,細胞發生凋亡。一旦發生內吞事件,PD-L1蛋白將進入溶酶體并被降解,隨著抗體和PD-L1的降解,針對癌細胞的細胞毒性藥物就會被釋放,然后殺傷PD-L1高表達的癌細胞。這也會產生“旁觀者效應”,可清除不表達PD-L1的癌細胞。

圖5.觀察腫瘤微環境中的紅色熒光,表示Caspase 3的活性增加
四、結論
基于他們的信號分析,演講者可以設計策略,努力分離能特異性識別糖基化PD-L1的單克隆抗體。他們第一次發現這個抗PD-L1抗體可以交聯結合在膜上的“PD-L1”分子,并且誘導這個蛋白的內吞作用,因此可以讓抗體攜帶細胞毒性藥物,通過內吞釋放該藥物,殺死癌細胞,引發對三陰性乳腺癌的深遠的療效。
中國科學院腦科學與智能技術卓越創新中心/上海腦科學與類腦研究中心研究員劉真、孫怡迪,博士后朱文成團隊,與復旦大學附屬中山醫院生殖醫學中心主治醫師木良善團隊、上海交通大學醫學院研究員李辰團隊合作,描繪了......
圖FUSEP化學生物學技術用于系統研究賴氨酸和非賴氨酸泛素化的位點信息在國家自然科學基金項目(22137004、22307062)資助下,清華大學藥學院尹航教授團隊在蛋白質泛素化研究領域取得新進展,開......
當前人工智能技術和產業有哪些熱點?我國人工智能產業發展呈現怎樣的特點?12月12日舉行的中國科學院人工智能產學研創新聯盟2024年會,為這些問題提供了答案。本次年會以“人工智能助力科研范式變革(AIf......
受大自然啟發,美國西北大學生物工程師團隊開發出一種植入皮下的傳感器,可實時跟蹤活體動物蛋白質水平的波動,測量炎癥標志物的變化。相關論文發表在《科學》雜志上,標志著醫學檢測領域的一個重要里程碑。為了檢測......
北京時間10月23日,在德國德雷斯頓舉行的2024HUPO大會頒獎典禮上,備受矚目的“ClinicalandTranslationalProteomicsAward”(臨床轉化蛋白質組學獎)榮耀加冕于......
【大會背景·研精覃思】第十屆BPIWEEK2025生物醫藥創新周將于2025年2月19-20日在上海盛大舉辦!大會由商圖信息舉辦,核心議題涵蓋從藥物研發、新靶點的發現、臨床、工藝與質量分析、商業化出海......
在今年諾貝爾化學獎表彰計算蛋白質設計領域的重大進展后,美國能源部阿貢國家實驗室團隊宣布開發出一種名為MProt-DPO的創新計算框架,該框架利用人工智能(AI)和世界頂尖的超級計算機,推動蛋白質設計取......
人工智能(AI)蛋白質設計正在走向“更快、更好、更強”。美國麻省總醫院布萊根分院和貝斯以色列女執事醫療中心團隊開發了一款名為EVOLVEpro的AI工具,被認為是蛋白質工程領域的一項重大突破。團隊在最......
近日,中國科學院生物物理研究所方顯楊課題組在《結構生物學的當前觀點》發表綜述,全面總結了利用非天然堿基對系統賦能分子標尺技術及其應用。隨著全球對由RNA病毒引起的病毒性疾病的關注度增加,如何通過深入理......
中國科學院生物物理研究所葉克窮研究組和北京生命科學研究所杜立林研究組合作,在裂殖酵母中發現一種新型殺手基因tdk1,并揭示其蛋白質產物控制細胞生存的分子和結構機制。兩篇相關論文11月1日發表于美國《國......