
孤兒藥(Ophan Drug)是指用于診斷、治療和預防罕見病的藥品,而罕見病是一類發病率極低的疾病的總稱,又被稱為“孤兒病”。根據世界衛生組織(WHO)的定義,患病人數占總人口0.65‰~1‰的疾病即可被定義為罕見病。不過,世界各國根據自己國家的具體情況,對罕見病的認定標準存在一定差異。
目前,國際上已經明確的罕見病超過7000種,雖然每種罕見病的患病人數較少,但整個罕見病患者群體卻十分龐大,全球預計有超過3億名罕見病患者,中國有超過1680萬罕見病患者。然而,與之形成鮮明對比的是,全球已上市的孤兒藥只有600多種。
孤兒藥具有研發難度大、成本高、目標市場小、獲利能力差等特征,因此最初很多藥企并不愿涉足該領域。美國最早于1983年1月4日頒布《孤兒藥法案》(ODA),之后又推出了孤兒藥審評的特殊待遇,再加上臨床研究和測試費用享受50%稅收抵免、處方藥用戶收費減免以及藥物獲準后享有7年市場獨占期等一系列支持政策,使得孤兒藥的社會認知度不斷提高,制藥企業對孤兒藥的開發熱情也持續升溫。近些年來,很多跨國制藥巨頭都紛紛加入了孤兒藥研發行列,并已收獲了重磅回報。
目前,孤兒藥已成為醫藥行業最盈利的板塊之一。根據醫藥市場調研機構Evaluate Pharma發布的《2019-2024年孤兒藥報告》,科學的進步將助推孤兒藥市場在未來6年(2019-2024)快速增長。報告指出,2018年全球孤兒藥市場為1310億美元,在未來6年(2019-2024),該市場將以12.3%的年度復合增長率快速增長,增速是同時期非孤兒藥市場增速(6%)的2倍,到2024年達到2420億美元(約合人民幣16297.49億元),其在處方藥市場中的占比將首次突破20%,達到20.3%。
在孤兒藥開發激勵和審批方面,美國始終走在世界最前列。根據FDA孤兒藥產品開發辦公室(OOPD)公共數據庫,自1983年《孤兒藥法案》(ODA)實施以來,FDA授予的孤兒藥資格數量和批準的孤兒藥適應癥數量逐年遞增。截至2020年3月31日,FDA已授予5323個孤兒藥資格,批準857個孤兒藥適應癥。其中,2020年第一季度,FDA已授予51個孤兒藥資格、批準9個孤兒藥適應癥。
以下是生物谷醫藥版塊小編根據OOPD公共數據庫對2020年第一季度美國FDA批準的9個孤兒藥適應癥的信息匯總。每月末,小編會對統計表格進行更新,并對這些孤兒藥適應癥進行盤點。希望相關藥物能盡快在中國上市,造福國內的罕見病患者群體。
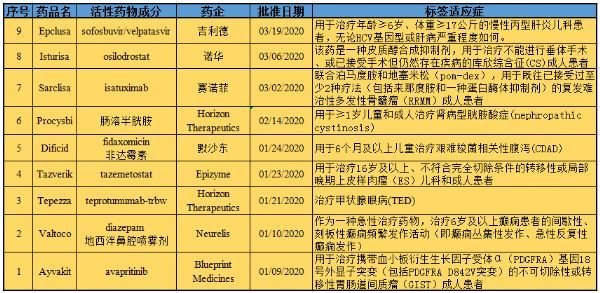
【9】兒科丙肝新藥!吉利德“吉三代”Epclusa(丙通沙)獲美國FDA批準,用于≥6歲、≥17公斤兒童!
3月19日,FDA批準吉利德丙肝藥物Epclusa(中文商品名:丙通沙,通用名:索磷布韋/維帕他韋,sofosbuvir/velpatasvir,400mg/100mg片劑)的一份補充新藥申請(sNDA),用于治療年齡≥6歲、體重≥17公斤的慢性丙型肝炎兒科患者,無論HCV基因型或肝病嚴重程度如何。用藥方面,Epclusa在≥6歲兒童中的推薦劑量基于體重和肝功能。值得一提的是,在美國,Epclusa是獲批用于治療丙肝成人患者和兒童患者的首個泛基因型、無蛋白酶抑制劑治療方案。
Epclusa是全球首個全口服、泛基因型、單一片劑丙肝治療方案,日服一次,用于全部6種基因型(GT-1,-2,-3,-4,-5,-6)丙肝患者的治療。該藥由吉利德已上市的丙肝明星藥Sovaldi(sofosbuvir)和另一種抗病毒藥物velpatasvir組成。其中,sofosbuvir是一種核苷類似物聚合酶抑制劑,velpatasvir則是一種泛基因型NS5A抑制劑。需要指出的是,Epclusa藥物標簽中附帶有一個黑框警告,提示該藥在丙肝/乙肝(HCV/HBV)合并感染的患者中具有再次激活乙肝病毒(HBV)的風險。
Epclusa于2016年6月獲批上市,隨著此次最新批準,該藥適用于年齡≥6歲、體重≥17公斤的慢性HCV基因型1-6感染的兒童和成人:(1)Epclusa單藥治療12周,用于無肝硬化或伴有代償期肝硬化(Child-Pugh A級)的丙肝患者;(2)Epclusa聯合利巴韋林(RBV)治療12周,用于伴有失代償期肝硬化(Child-Pugh B或C級)的丙肝患者。(3)對于丙肝和艾滋病(HCV/HIV)共感染者,以及伴有腎損害(包括透析治療終末期腎病)的感染者,給藥方案根據肝硬化情況按(1)或(2)的方案進行治療。
吉利德針對丙肝共開發了四代產品,全部已在中國獲批上市,分別為:Sovaldi(索華迪,“吉一代”)、Harvoni(夏帆寧,“吉二代”)、Epclusa(丙通沙,“吉三代”)、Vosevi(“吉四代”)。其中,“吉四代”Vosevi是全球首個獲批作為挽救療法用于特定丙肝患者的每日一次單一片劑,同時也是吉利德基于SOF的HCV直接作用抗病毒(DAA)藥物管線的收官之作。值得注意的是,4種的美國藥物標簽中附帶有一個黑框警告,提示該藥在丙肝/乙肝(HCV/HBV)共感染的患者中,可能有導致乙肝病毒(HBV)再度激活的風險。
【8】庫欣綜合征(CS)新藥!美國FDA批準首個直接解決皮質醇分泌過量的藥物Isturisa!
3月6日,FDA批準Isturisa(osilodrostat,口服片劑),用于治療庫欣綜合征(Cushing’s syndrome,CS)成人患者,具體為:不能進行垂體手術、或已接受手術但仍然患病的成人患者。庫欣綜合征(CS)是一種罕見疾病,由腎上腺分泌過多的皮質醇引起。Isturisa是FDA批準的第一個通過阻斷11β-羥化酶和阻止皮質醇生物合成直接解決皮質醇過量產生的藥物。
Isturisa由諾華開發。2019年7月,諾華將Isturia在內的3款內分泌藥物以3.9億美元出售給了意大利制藥公司Recordati。在歐盟,Isturisa于2020年1月獲得批準,用于治療成人內源性庫欣綜合征(CS)。Isturisa有3種規格:1mg、5mg、10mg薄膜包衣片。
Isturisa的活性藥物成分是osilodrostat,這是一種皮質醇合成抑制劑,通過抑制11-β羥化酶發揮作用,這種酶負責腎上腺皮質醇生物合成的最后一步。Isturisa的好處是它能夠控制或使成人CS患者的皮質醇水平正常化,并具有可管理的安全性,使該產品成為CS患者有價值的治療選擇。
根據百度百科,庫欣綜合征(CS)又稱皮質醇增多癥(hypercortisolism),過去也有人稱其為柯興綜合征,是由于機體多種病因引起的腎上腺皮質長期分泌過多糖皮質激素(主要為皮質醇)所產生的一系列的臨床表現,也稱為內源性庫欣綜合征。高發年齡在20~40歲,男女發病率之比約為1:3。按其病因可分為促腎上腺皮質激素(ACTH)依賴型和非依賴型兩種。主要表現為滿月臉、多血質外貌、向心性肥胖、痤瘡、紫紋、高血壓、繼發性糖尿病和骨質疏松等。此外,長期應用大劑量糖皮質激素或長期酗酒也可引起類似庫欣綜合征的臨床表現,稱為外源性、藥源性或類庫欣綜合征。
【7】多發性骨髓瘤新藥!賽諾菲CD38抗體Sarclisa獲美國FDA批準,劍指強生年銷$30億重磅藥Darzalex!
3月2日,FDA批準賽諾菲CD38靶向抗體藥物Sarclisa(isatuximab-irfc),聯合泊馬度胺和地塞米松(pom-dex),用于既往已接受過至少2種療法(包括來那度胺和一種蛋白酶體抑制劑)的復發難治性多發性骨髓瘤(RRMM)成人患者。
多發性骨髓瘤(MM)是第二常見的血液癌癥,大多數患者最終不幸復發,對目前可用的療法難治。Sarclisa聯合pom-dex方案,將為這些患者提供一個重要的新治療選擇。支持該藥物批準的III期ICARIA-MM研究入組的是特別難以治療且預后極差的復發和難治性MM患者,這反映了現實世界的臨床實踐。結果顯示,在這類患者中,與標準護理(pom-dex)相比,Sarclisa與pom-dex聯合治療將疾病無進展生存期顯著延長(中位PFS:11.53個月 vs 6.47個月)、疾病進展或死亡風險顯著降低40%(HR=0.596;95%CI:0.44-0.81;p=0.0010)、總緩解率顯著提高(ORR:60.4% vs 35.3%,p<0.0001),并且在各個亞組中均表現出治療益處,包括年齡≥75歲的患者、腎功能不全患者、來那度胺難治患者。,
Sarclisa的活性藥物成分isatuximab是一種IgG1嵌合單克隆抗體,靶向漿細胞CD38受體的特定表位,能夠觸發多種獨特的作用機制,包括促進程序性腫瘤細胞死亡(凋亡)和免疫調節活性。CD38在多發性骨髓瘤(MM)細胞上呈高水平表達,是MM和其他惡性腫瘤中抗體治療的細胞表面受體靶標。在美國和歐盟,isatuximab均被授予了治療R/R MM的孤兒藥資格。目前,賽諾菲也正在評估isatuximab治療其他血液系統惡性腫瘤和實體瘤的潛力。
Sarclisa上市后將成為強生重磅CD38靶向藥物Darzalex的第一個直接競爭對手,后者于2015年上市,2019年全球銷售額達到29.98億美元,較上一年增幅達48.0%。華爾街投資銀行Jefferies分析師預計,Sarclisa上市后的年銷售峰值將突破10億美元。
【6】腎病型胱氨酸癥新藥!美國FDA批準Procysbi口服顆粒劑,用于≥1歲患者!
2月14日,FDA批準Horizon Therapeutics公司Procysbi(cysteamine bitartrate,半胱胺酒石酸,腸溶)延遲釋放口服顆粒劑,用于一歲及以上兒童和成人治療腎病型胱胺酸癥(nephropathic cystinosis)。除了目前可用的Procysbi膠囊,這種新的劑型將為腎病型胱氨酸癥患者提供另一種選擇。
Procysbi膠囊和袋裝均含有相同的Procysbi顆粒,也被稱為微珠,可提供12小時的胱氨酸控制。對于有吞咽困難的胱氨酸癥患者,袋裝口服顆粒將提供一種可撕開的選擇,可將顆粒撒在某些食物或液體上服用,或通過胃造口管(g-tube)進行給藥。患有胱氨酸癥的家庭通常面臨著每天管理多種不同藥物的挑戰,而可撕包裝袋中的口服顆粒劑將為日常使用Procysbi提供另一種選擇。
腎病型胱胺酸癥是一種罕見的、危及生命的代謝性溶酶體儲存障礙,可導致體內所有細胞、組織和器官中胱氨酸的毒性積聚。如果未經治療,胱氨酸積累增加會導致進行性、不可逆的組織損傷和多器官衰竭,包括腎衰竭、失明、肌肉萎縮和過早死亡。據估計,目前全世界只有約2000人被診斷為腎病型胱胺酸癥。腎病型或“典型嬰兒型”胱氨酸癥是胱氨酸癥最常見和最嚴重的類型,通常在嬰兒期確診,需要終生的胱氨酸耗竭治療。
Procysbi延遲釋放膠囊和延遲釋放口服顆粒是一種胱氨酸消耗劑,用于治療1歲及1歲以上兒童和成人的腎病型胱胺酸癥。Procysbi延遲釋放膠囊包括25毫克和75毫克劑量強度,Procysbi延遲釋放口服顆粒規格有每包75mg和300mg。
【5】抗生素新藥!默沙東Dificid(非達霉素)獲美國FDA批準,用于≥6個月兒童治療艱難梭菌感染!
1月24日,FDA批準默沙東(Merck & Co)公司Daficid(fidaxomicin,非達霉素)口服混懸劑以及Dificid片劑,用于6個月及以上兒童治療艱難梭菌相關性腹瀉(CDAD)。在2010年,Dificid被授予了兒科適應癥的孤兒藥資格。
艱難梭菌(C.diffi,CD)是美國醫院最常見的健康相關感染的原因之一。最近的估計表明,CD在美國每年導致近50萬人感染,并與最初診斷后30天內約2.9萬人的死亡相關。根據美國疾病控制和預防中心(CDC)發布的《2019年美國抗生素耐藥性威脅(Antibiotic Resistance Threats in the United States, 2019)》報告,CD被歸類為緊急威脅,并被列為需要緊急和積極行動的公共健康威脅。
Dificid是一種大環內脂類抗生素,具有一種新的作用機制和一個選擇性抗菌譜,該藥主要是通過抑制細菌的RNA聚合酶而產生迅速的抗難治梭狀芽孢桿菌感染(CDI)作用。Dificid適用于6個月及以上兒童和成人治療艱難梭菌相關性腹瀉(CDAD)。
為減少耐藥菌的形成以及維持Dificid和其他抗菌藥物的有效性,Dificid應僅用于治療已被證實或強烈懷疑由艱難梭菌引起的感染。Dificid禁用于對fidaxomicin(非達霉素)或Dificid中任何其他成分過敏的患者。Dificid應僅用于治療艱難梭菌相關性腹瀉(CDAD)。由于fidaxomicin的系統性吸收很少,Dificid不能有效治療其他類型的感染。
【4】首個EZH2抑制劑!Epizyme表觀遺傳學藥物Tazverik獲美國FDA批準,首個上皮樣肉瘤(ES)治療藥物!
1月23日,FDA批準Epizyme公司表觀遺傳學藥物Tazverik(tazemetostat),用于治療16歲及以上、不符合完全切除條件的轉移性或局部晚期上皮樣肉瘤(ES)兒科和成人患者。值得一提的是,Tazverik是獲美國FDA批準的第一個也是唯一一個EZH2抑制劑,也是該機構批準專門針對ES患者的第一個也是唯一一個療法。
Tazverik的活性藥物成分tazemetostat是一種口服、強效、首創(first-in-class)、EZH2抑制劑。EZH2是一種組蛋白甲基轉移酶,如被異常激活,將導致控制細胞增殖的基因失調,從而可引起非霍奇金淋巴瘤(NHL)及其他多種實體瘤細胞的無限制迅速生長。tazemetostat可通過抑制EZH2酶活性而發揮抗腫瘤作用。在臨床研究中,tazemetostat在治療早期就表現出了安全有效地縮小甚至消除腫瘤的能力。
目前,Tazverik還有一份新藥申請(NDA)正在接受FDA的優先審查,用于治療先前已接受過至少2種系統療法的復發或難治性濾泡性淋巴瘤(R/R FL)患者。II期研究數據顯示,在EZH2突變FL患者、野生型EZH2 FL患者中,Tazverik治療的總緩解率(ORR)分別為69%、35%。當前,濾泡性淋巴瘤(FL)仍然是一種毀滅性的不治之癥。如果獲批準,Tazverik將為攜帶或不攜帶EZH2激活突變的FL患者群體帶來一種新的治療選擇。
【3】首個甲狀腺眼病治療藥物!Horizon公司IGF-1R靶向單抗Tepezza(teprotumumab)獲美國FDA批準!
1月21日,FDA批準Horizon Pharma公司單抗藥物Tepezza(teprotumumab-trbw),用于治療甲狀腺眼病(TED)。值得一提的是,Tepezza是FDA批準的第一種也是唯一一種治療TED的藥物。
TED是一種嚴重的、進行性的、威脅視力的罕見自身免疫性疾病,與突眼(眼球膨出)、復視、視力模糊、疼痛、炎癥和面部缺陷相關。Tepezza是一種全人單克隆抗體和胰島素樣生長因子-1受體(IGF-1R)靶向制劑,每三周注射一次,共注射8次。
在III期OPTIC研究中,與安慰劑組相比,teprotumumab治療組患者眼球突出或鼓脹表現出顯著改善,達到了主要終點:teprotumumab治療組有82.9%的患者達到眼球突出或鼓脹減少2mm或更多的主要終點,而安慰劑組僅為9.5%,數據具有統計學顯著差異(p<0.001)。眼球突出(proptosis)是TED患者發病的主要原因。此外,該研究也達到了全部次要終點,包括復視減少、生活質量改善、臨床活動評分降低。該研究中,teprotumumab的耐受性良好,大多數不良事件是輕度或中度,在治療期間或治療后可以控制和解決。來自II期研究的數據顯示,teprotumumab治療使眼球突出和活動性TED癥狀(疼痛、腫脹、紅腫、炎癥)取得臨床意義和高度統計學意義的減少。
【2】癲癇重大進展!首個鼻腔噴霧治療急性反復發作的藥物Valtoco(地西泮鼻腔噴劑)獲美國FDA批準!
1月10日,FDA批準Neurelis公司藥物Valtoco(地西泮鼻腔噴霧劑),作為一種急性治療藥物,治療6歲及以上癲癇患者的間歇性、刻板性癲癇頻繁發作活動(即癲癇叢集性發作、急性反復性癲癇發作),這種發作不同于患者通常的癲癇發作模式。Valtoco的獨特配方融入了Intravail技術,可實現始終如一的可靠吸收,已被證明具有普遍的安全性和良好的耐受性。
值得一提的是,Valtoco是FDA批準用于6歲及以上癲癇患者用作急性治療藥物的第一種鼻腔噴霧劑。Valtoco還被FDA孤兒產品開發辦公室授予了為期7年的孤兒藥專營權。直到最近,在醫療機構之外的批準方案只能作為直腸給藥。因此,FDA批準Valtoco鼻腔噴霧劑,對癲癇社區來說是一個重大的進步。
Valtoco是一種ZL配方的diazepam(地西泮),融入了一種基于維生素E的溶液和Intravail?吸收增強技術的獨特組合。之前,FDA已授予Valtoco孤兒藥地位和快速通道地位。Intravail?經粘膜吸收增強技術可以無創性地輸送多種蛋白質、肽和小分子藥物。
據估計,在美國大約有340多萬癲癇患者,每年大約確診20萬新病例。盡管有慢性的每日口服藥物控制癲癇,但仍有相當一部分的患者繼續經歷癲癇發作。在這些不受控的患者中,約有17萬的患者有頻繁發作的風險,也被稱為叢集性或急性反復癲癇發作,這類發作在癲癇患者的生活中既危險又極具破壞性。Valtoco將為這類患者提供一種安全可靠、耐受性良好、簡單即用的鼻腔噴霧劑,可使照料者在任何時間、任何地點可靠地治療癲癇發作,這是一個重大進步。Valtoco的上市,將會對成千上萬的經歷叢集性或急性反復性癲癇發作的癲癇患者及其護理伙伴的生活產生積極影響。
【1】胃腸道間質瘤(GIST)邁入精準醫療新時代!美國FDA批準靶向藥Ayvakit,基石藥業擁有中國權利!
1月9日,FDA批準Blueprint Medicines公司靶向抗癌藥Ayvakit(avapritinib),用于治療攜帶血小板衍生生長因子受體α(PDGFRA)基因18號外顯子突變(包括PDGFRA D842V突變)的不可切除性或轉移性胃腸道間質瘤(GIST)成人患者。值得一提的是,Ayvakit是第一個被批準用于GIST的精準療法,也是唯一一個對PDGFRA基因18號外顯子突變型GIST具有高活性的藥物。基石藥業用于Ayvakit在大中華區的開發與商業化權利。
臨床數據顯示,在PDGFRA基因18號外顯子突變的GIST患者中,Ayvakit治療的總緩解率(ORR)高達86%(95%CI:69%,93%),且中位緩解持續時間(DOR)尚未達到。GIST是一種罕見的由基因組驅動的胃腸道肉瘤。約6%的新診斷GIST患者具有PDGFRA外顯子18突變。最常見的PDGFRA外顯子18突變是D842V突變,它對所有其他已批準的療法都是耐藥的。
Ayvakit的活性藥物成分為avapritinib,可選擇性和強效地抑制KIT和PDGFRA突變激酶。該藥是一種I型抑制劑,旨在靶向活性激酶構象;所有致癌激酶都通過這種構象進行信號傳導。avapritinib已被證實對胃腸道間質瘤(GIST)相關的KIT和PDGFRA突變具有廣泛的抑制作用,包括針對與當前批準療法耐藥相關的激活loop突變的強勁活性。與已批準的多激酶抑制劑相比,avapritinib對KIT和PDGFRA的選擇性明顯高于其他激酶。
日前,遠大醫藥發布公告稱集團用于治療胃腸胰腺神經內分泌瘤的全球創新放射性核素偶聯藥物ITM-11的新藥臨床試驗申請,近日已獲得國家藥品監督管理局正式受理。ITM-11是一款基于放射性核素偶聯技術靶向殺......
東亞前海證券10月12日發布研報稱,給予榮昌生物(688331.SH,最新價:47.31元)推薦評級。評級理由主要包括:1)泰它西普治療重癥肌無力(MG)獲“孤兒藥”資格認定,加速其搶占國際市場;2)......
NeurocrineBiosciences公司前不久宣布,該公司valbenazine已獲得美國食品和藥物管理局(FDA)的孤兒藥資格認定,用于治療亨廷頓舞蹈癥(Huntingtondisease,H......
美國食品和藥物管理局官網數據庫顯示,已進入治療新冠肺炎臨床試驗的藥物瑞德西韋23日被藥管局認定為“孤兒藥”,涉及適應癥為新冠肺炎。瑞德西韋是美國吉利德科技公司一款在研藥,尚未在全球任何地方獲批上市。美......
“全世界并不是只有美國一個市場,只要拿得出讓人信服的數據,總會被認可的。”北京時間2月11日凌晨3點半,還有數萬名來自生物醫藥領域的從業者、投資者熬夜守候在直播間。他們正在線上圍觀一場醫藥評審會議。這......
2022年1月28日獲悉,南京北恒生物科技有限公司開發的抗Claudin18.2自體CAR-T細胞治療產品CTB001,已收到美國FDA授予的孤兒藥資格(ODD),用于治療胃癌。CTB001是一種靶向......
孤兒藥周報| 上周FDA共頒發4項孤兒藥資格,包括1款化學小分子、1款小分子靶向藥、1款疫苗、1款單克隆抗體。其中包括武田開發的靶向α4β7整合素的維得利珠單抗,以及Precigen治療復發......
上周FDA共頒發4項孤兒藥資格,包括3款小分子靶向藥、1款融合蛋白,其中包括由Alkermes開發,治療黏膜黑色素瘤的IL-2選擇性激動劑nemvaleukinalfa(ALKS4230),以及RNR......
AcceleronPharma是一家致力于發現、開發和商業化TGF-β超家族療法用于治療嚴重和罕見疾病的生物制藥公司,近日,該公司宣布,美國食品和藥物管理局(FDA)已授予sotatercept(AC......
2019年7月,美國食品藥品監督管理局(FDA)發布了關于抗病毒藥物產品提交二代測序數據的指南。指南為抗病毒藥物產品向FDA提交二代核苷酸序列分析程序以及支持耐藥性評估數據提供了意見。一、背景信息為保......