導 讀
基于質譜的蛋白質組學使得對阿爾茨海默癥(AD)的蛋白質組和蛋白質翻譯后修飾(PTM)的深入剖析成為可能。在這里,我們回顧了AD蛋白質組學研究的歷史和近期的進展以及局限。作為遺傳圖譜的補充,蛋白質組學研究不僅驗證了典型的淀粉樣蛋白和tau通路,而且還發現了蛋白質網絡中的新組成部分,如RNA剪接、發育、免疫、膜運輸、脂質代謝、突觸功能和線粒體活性。7個深層數據集的Meta分析顯示,AD腦蛋白質組(n=12017個蛋白質/基因)中有2,698個差異表達(DE)的蛋白質,覆蓋了35個已報道的AD基因和危險位點。DE蛋白含有富含神經元、小膠質細胞、星形膠質細胞、少突膠質細胞和上皮細胞的細胞標志物,支持多種細胞類型參與AD的病理過程。我們討論了選定DE蛋白的假設保護作用或有害作用,強調“淀粉樣蛋白組”(淀粉樣斑塊中的所有生物分子)和疾病進展中的頂級蛋白。全面的PTM分析代表了AD中的另一層分子事件。特別是,tau PTM與疾病分期相關,表明AD患者個體的異質性。此外,腦脊液和血清等生物體液具有前所未有的蛋白質組學覆蓋范圍,并且薈萃分析可獲得新的AD生物標志物。因此,蛋白質組學驅動的系統生物學為將基因型、蛋白類型和表型聯系起來提供了一個新的領域,加速了改進的AD模型和治療策略的發展。
論文ID
原名:Proteomic landscape of Alzheimer’s Disease: novel insights intopathogenesis and biomarker discovery
譯名:阿爾茨海默癥的蛋白質組學格局:發病機制和生物標志物發現的新見解
期刊:Molecular Neurodegeneration
IF:14.195
發表時間:2021.08
通訊作者:白冰
通訊作者單位:圣裘德兒童研究醫院結構生物學系
內容
1.背景
阿爾茨海默癥(AD)是一種與衰老相關的神經退行性疾病,作為癡呆癥最常見的形式,在美國大約有580萬人受到折磨。據估計,全世界有5000萬人患有阿爾茨海默氏癥和其他類型的癡呆癥。隨著人口逐漸老齡化,AD給美國醫療保健系統帶來的經濟負擔目前為3050億美元,在不久的將來還將大幅增長。典型的AD發病發生在65歲之后(晚發性AD,LOAD),盡管不到5%的AD病例出現在早期(早發性AD,EOAD),而1-2%的AD病例是在家族內遺傳的(家族性AD)。該病的主要臨床表現包括嚴重的認知功能減退、進行性記憶喪失、逆行性和順行性健忘,并伴有嚴重的組織病理學改變,如海馬退化和隨后的皮質物質丟失。AD通常表現為額外的合并癥,如運動和心理障礙,以及各種睡眠障礙。這些不同的癥狀在某些情況下混淆了AD的診斷。廣泛的分子研究揭示了這種疾病的病理特征:由淀粉樣蛋白(Aβ,Aβ)多肽組成的淀粉樣斑塊,以及含有過度磷酸化tau的神經纖維纏結(NFT)可用于疾病分期(如Braak分期)。盡管幾十年來人們積極研究藥物開發,以及最近有爭議的阿杜卡努單抗(也被稱為Aduhelm)用于AD治療,但這種大腦退化的確切原因還沒有完全弄清楚,這種毀滅性疾病的治愈仍是遙不可及的。
對AD發病機制的基本認識來自于互補的遺傳/基因組和生化/蛋白質組學研究。1984年,Glenner和Wong從AD患者的斑塊中分離出一種β肽,后來對其進行了部分測序,隨后促使了β-淀粉樣前體蛋白(APP)的基因克隆。這一生化發現后來得到了致病AD基因的基因突變圖譜的證實,包括1991年的APP和1995年的早老素(PSEN1/PSEN2)。生化和遺傳學證據的結合證實了AD的一種直觀的分子機制,即APP被β-分泌酶(BACE1)和γ-分泌酶(含PSEN1/PSEN2)依次水解產生淀粉樣蛋白Aβ肽。綜上所述,這些結果引出了淀粉樣蛋白假說,認為APP裂解的Aβ物種在推動AD發病中起著中心作用。同時在1986年左右,人們證明過度磷酸化的tau是AD腦組織中神經原纖維纏結的主要成分。Tau基因(MAPT)的突變與其他幾種神經退行性疾病有關,如額顳葉癡呆(FTD)。生化和遺傳學證據再次確定了tau假說,并強調了tau在AD進展中的關鍵作用。本世紀初的實驗表明,Aβ在認知缺陷之前聚集,后來下游tau積累會引發神經毒性。目前的研究范式已經從Aβ沉積轉向了解不同Aβ形式的毒性,特別是可溶性Aβ寡聚體。錯誤折疊的Aβ和tau也可能在神經變性過程中作為“病態種子”傳播。
人們假設了無數的其他模型:膽堿能,鈣,線粒體,膜運輸,炎癥,淋巴,微生物感染,神經血管和細胞相假說,然而這些替代性的概念與淀粉樣蛋白和tau理論框架仍然難以區分。事實仍然是,Aβ可能是導致AD的必要因素,但不是充分因素。然而,介導A-β和tau毒性的分子途徑、細胞回路和病理生理機制尚不完全清楚。
基因組學和蛋白質組學中大規模測序技術的創新加速了AD領域的發現。除了APP、PSEN1和PSEN2,早在1993年的遺傳學研究中人們就發現了APOE4是AD的主要風險基因。目前的高通量遺傳/基因組分析揭示了新的風險基因,如TREM2和unc5C,以及160多個可能與淀粉樣蛋白、tau、內吞和免疫相關的風險位點。2014年,美國國立老齡研究院發起了加速藥物伙伴關系(AMP)-AD計劃,利用學術界和工業界的多學科戰略,旨在發現新的治療靶點和生物標志物。多組學方法為理解AD的復雜性提供了一個不可或缺的系統工具。雖然AD遺傳學領域在過去幾年中已經被大量綜述,這里我們打算回顧AD蛋白質組學領域。在PubMed的文獻庫中搜索關鍵詞“阿爾茨海默氏癥或阿爾茨海默氏癥”和“蛋白質組學或蛋白質組”,出現2000多篇出版物,盡管AD蛋白質組學是在本世紀初才出現,但2020年有300多篇論文,并且一直在穩步增長。最近的許多工作致力于描繪大腦深層蛋白質組、分析大樣本并解剖亞蛋白質組、研究復雜的PTM模式、并在生物液中鑒定新的候選生物標志物。我們討論了蛋白質分析技術和應用的歷史、現狀和未來,并通過薈萃分析提供了AD蛋白質組學的整體格局,揭示了AD發病機制和潛在生物標志物的新見解。
2.蛋白質分析和質譜技術的發展
本綜述概述了上個世紀對基于質譜(MS)的蛋白質分析作出貢獻的主要事件(圖1)。在進行基于質譜的蛋白質組學分析之前,Pehr Edman在1967年報道了一種蛋白質的測序技術(Edman降解法),但是最多只能測出30個氨基酸,每個殘基大約需要一個小時。正是用這種技術,Wang等人對Aβ多肽的前28個殘基進行了測序。幾個研究小組使用20世紀60年代問世的商用質譜儀對寡肽的氨基酸進行排序并提供了理論證據。20世紀80年代末兩種獲得諾貝爾獎的軟電離方法(基質輔助激光解吸/電離(MALDI)和電噴霧電離(ESI) )發明出來前,質譜在蛋白質測序中的應用一直受限。MALDI早期是一種流行的電離技術,而ESI現在是復雜混合物中蛋白質組學分析的主導方法。這些技術的發展使蛋白質的高通量質譜分析成為可能。
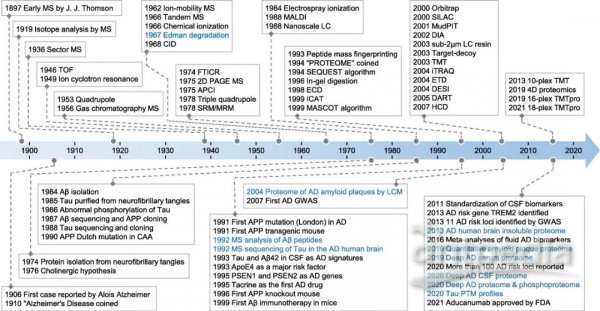
圖1 質譜和AD研究中的重大歷史事件
Edman降解也包括在內并重點介紹了AD蛋白質組學研究。該信息由幾個在線資源(https://www.nature.com/collections/aajfehieag,https://www.hupo.org/Proteomics-Timeline,https://masspec.scripps.edu/learn/ms,https://www.alzforum.org/timeline,和https://www.alzheimers.net/history-of-alzheimers)以及參考文獻匯編而成。質譜檢測儀器包括扇形質譜、飛行時間法(TOF)、四極桿法、傅里葉變換離子回旋共振(FTICR)、三重四極桿和軌道阱法。常用的電離方法包括大氣壓化學電離(APCI)、電噴霧電離(ESI)、基質輔助激光解吸電離(MALDI)、解吸電噴霧電離(DESI)和實時直接分析(DART)。生物分子可以通過使用2μm樹脂的納米級液相色譜(LC)或多維蛋白質識別技術(MudPIT)進行分離以提高分辨率。MS前體離子可以通過碰撞誘導解離(CID)、電子俘獲解離(ECD)、電子轉移解離(ETD)或高能碰撞解離(HCD)來碎裂。定量策略包括二維聚丙烯酰胺凝膠電泳(2D PAGE)、同位素編碼親和標記(ICAT)、細胞培養中氨基酸穩定同位素標記(SILAC)、串聯質量標記(TMT)、相對和絕對定量等壓標記(ITRAQ)以及數據獨立性采集(DIA)方法。選擇/多反應監測(SRM/MRM)是一種用于分析預定義分子的質譜技術。數據庫搜索工具包括SEQUEST、MASCOT和目標誘餌策略。CAA:大腦淀粉樣血管病;LCM:激光捕獲顯微解剖;GWAS:全基因組關聯研究;CSF:腦脊液;FDA:美國食品和藥物管理局
基于MS的蛋白質組分析通常由三個主要步驟組成(圖2):(i)質譜前樣本處理,(ii)MS數據采集,以及(iii)生物信息學;每一步都提供了各種各樣的策略,以實現蛋白質鑒定和定量的最終分析目標。例如,人們可以選擇自上而下或自下而上的策略,分別分析全長蛋白質或多肽(例如,胰蛋白酶消化的蛋白質)。由于蛋白質組內高度多樣化的生化特性,在一個統一的條件下分析完整蛋白質的自上而下的方法是具有挑戰性的。一項最全面的自上而下的研究從大約1000個人類基因中確定了3000多種蛋白質亞型。相比之下,自下而上的蛋白質組學依賴于對從完整蛋白質中酶解的多肽分析,使樣本在生物化學上是同質的,從而將蛋白質組覆蓋范圍提高到10000多種蛋白質,盡管在將識別的多肽映射到蛋白質上存在差距。在自下而上的蛋白質組學中,水解的多肽通常用液相色譜(LC)分離,用ESI電離,然后用串聯質譜(MS/MS或MS2)進行分析。等電聚焦也適用于肽的高分辨分離。應該注意的是,MS2本身是一種強大的分離工具,能夠根據質量/電荷比(m/z)從其他共洗脫的多肽中選擇指定的多肽。自下而上方法由于其靈敏度、吞吐量、穩健性和蛋白質組覆蓋率等優點,被廣泛應用于非靶向蛋白質組分析。
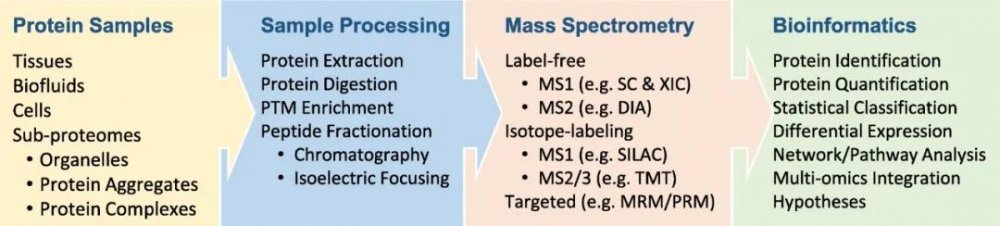
圖2 蛋白質樣品的質譜前處理、質譜數據采集和質譜后生物信息學數據處理
蛋白質定量可以通過無標記方法,如光譜計數(SC)、提取離子流圖(XIC)和數據獨立性采集(DIA),或通過同位素標記方法,如SILAC和TMT來實現。此外,質譜還可通過多反應監測(MRM)或平行反應監測(PRM)分析目標蛋白/肽。
目前人們有許多自下而上的蛋白質組學策略可用,可分為無標記和穩定同位素標記方法。無標記方法已經從半定量的光譜計數(通過指定的MS2光譜的總數來估計蛋白質的水平)發展到在MS1或MS2掃描中更精確地提取離子流圖。穩定同位素標記方法始于化學蛋白質標記,如Cys-反應性ICAT,胺-反應性二甲基標記法,然后是代謝蛋白標記法(如SILAC),其中肽/蛋白的定量是通過混合樣品中的差異標記的MS1峰來實現的。然而,混合譜圖增加了MS1的復雜性,降低了肽的鑒定效率。為了克服這一限制,我們已經開發了等重肽標記方法,例如iTRAQ、TMT和Dileu,以產生等重MS1峰并實現多重標記(例如11-Plex、16-Plex、18-Plex和27-Plex TMT)。同位素峰碎裂后,釋放不同的報告離子,以便在MS2/3掃描中進行相對定量。
在MS數據采集期間,儀器在數據相關采集(DDA)模式或數據無關采集(DIA)的替代模式下運行。在DDA中,光譜儀利用MS1調查掃描在較小的分離窗口(例如0.5-2 m/z)中選擇最豐富的肽離子(例如前10個),然后依次將其碎片化以生成MS2掃描。雖然這種方法效率極高,但DDA中的一些豐度較低的肽離子在容檢測過程中易被遺漏。為了緩解采樣不足的問題,DIA在整個質量范圍內設置了連續的隔離窗口(例如10-50m/z),并不加區別地粉碎所有離子。然而,掃描所有DIA窗口會增加時間依賴性。因此,在快速掃描質譜儀出現之前,DIA的效率較低。關于質譜儀器,早期的分析人們使用了飛行時間(TOF)質譜儀,它們很容易與MALDI結合。后來,三重四極桿(QQQ)和線性離子阱因其成本效益而被推廣為低分辨率質譜,而昂貴的傅立葉變換儀器(FTICR)則被用于高分辨率檢測。如今,有了離子遷移率光譜(IMS)提供的離子分離能力,飛行時間(TOF)儀器得到了顯著改進。此外, Orbitrap儀器的發明為基于MS的蛋白質組學帶來了革命性的變化,它為蛋白質組圖譜提供了一種強大而高分辨率的方法。
質譜生物信息學工具從原始質譜數據中提取準確的信息,用于蛋白質鑒定和定量。它可以用計算程序搜索大型蛋白質數據庫或MS譜庫,以將MS2譜匹配給目標肽。人們在其他地方已經開發了大量的搜索算法。大規模蛋白質數據庫搜索的一個問題是容易引入錯誤鑒定肽段,這已經通過引入目標-誘餌庫搜索策略來解決,它能降低鑒定蛋白質的錯誤發現率(例如<1%)。在蛋白質鑒定之后,通常進行定量以評估樣品中的蛋白質豐度,然后進行差異表達(DE)和網絡分析以得出可檢驗的假說。
總體而言,強大的自下而上的蛋白質組學方法需要MS前、MS中和MS后設置的無縫結合。鑒定出的蛋白質數量是評估蛋白質組技術必不可少的指標,因為關鍵的調節蛋白通常在細胞中以低豐度存在,這不是淺層蛋白質組分析所能檢測到的。為了實現超深蛋白質組覆蓋,目前研究中人們多數使用多路TMT標記結合蛋白質組學平臺(例如TMT-LC/LC-MS/MS)、二維HPLC(例如堿性和酸性pH反相液相色譜)和高分辨率MS中的DDA(圖3)。該平臺最近產生了大量的深層AD蛋白質組數據。LC-IMS-DIA-MS是一個很有前途的無標記平臺,它結合了離子遷移率光譜、一維LC和MS中與數據獨立性采集,可以從腦組織中分析大約10000個蛋白質。除了質譜之外,人們還可以使用特定的親和試劑來分析蛋白質,例如抗體(例如蛋白質芯片、ELISA和鄰近延伸分析)和適配子(例如SOMAscan)。這些非質譜技術在處理大量樣品時是有利的,但目前試劑可用性和特異性的缺陷阻礙了整個蛋白質組的覆蓋。
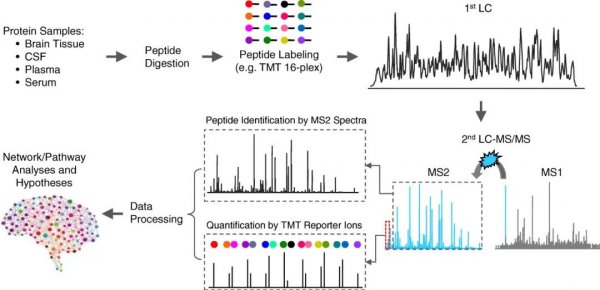
圖3 TMT-LC/LC-MS/MS的深層蛋白質組學工作流程
TMT試劑用不同的顏色表示,它們與肽N末端和賴氨酸殘基上的胺基發生反應。除胺反應基團外,等重TMT試劑還含有一個報告離子基團和一個平衡基團。報告基團中的質量差被平衡基團抵消,從而實現等重標記和合并。用LC/LC對合成的多肽進行分離,鑒定為混合的等重前體離子。在碎裂之后,TMT標簽在報告基團和平衡基團之間被切割,產生用于定量的報告離子
3. 對 AD 蛋白質組進行無偏分析
不斷發展的蛋白質組學技術研究了臨床AD標本,以闡明該病在不同時期的潛在生物分子機制(圖1)。在前基因組時代,不完整的蛋白質數據庫將MS分析局限于已知的AD蛋白質(例如Aβ和tau)。LC-ESI-MS和MALDI-TOF-MS研究了淀粉樣斑塊的組成,鑒定了不同Aβ多肽的可溶性和不溶性。MS還鑒定出異常修飾的tau種類,包括磷酸化、乙酰化和脫酰胺化。隨著2003年人類基因組計劃的完成,第一個全面的人類蛋白質數據庫問世,為大規模和公正的蛋白質組分析提供了基礎;然而,蛋白質組學技術又花了十年的時間才開發出與人類蛋白質組深度相匹配的蛋白質組。
對于分析整個蛋白質組的早期挑戰,亞蛋白質組分析似乎是一種有效的策略。2004年,Liao等人提出通過激光捕獲顯微解剖(LCM)(一種解剖和分離感興趣組織區域的技術)表征死后AD腦組織中的淀粉樣斑塊蛋白質組,通過捕獲標記有硫黃素-S的淀粉樣斑塊進行蛋白質提取和MS分析,結果共鑒定出488種蛋白質。斑塊組織與非斑塊組織比較,斑塊區域有26個DE蛋白富集。這項初步研究表明,淀粉樣斑塊中可能積聚了大量蛋白質。為簡單起見,我們使用術語“淀粉樣體”來表示淀粉樣斑塊中的所有生物分子。使用類似的方法,Drummond等人定量了AD亞型淀粉樣體中的900多個蛋白質,報告了快速進展型AD和散發性AD的蛋白質差異。2019年,Xiong等人用LCM和目前的TMT-LC/LC-MS/MS方法對AD淀粉樣體進行了更深入的重新分析,將蛋白質組覆蓋范圍增加到4000多個,其中包括40個高度富集在斑塊區的DE蛋白質,APOE和補體蛋白。
由于其低溶解度,AD樣本的差異性生化提取提供了富集聚集蛋白組的另一種方法。2009年Gozal等人著手分析AD中的洗滌劑不溶性蛋白質組,即有序分離結合凝膠電泳和LC-MS/MS分析了512個蛋白質,其中11個蛋白質在AD樣本中增加。2013年人們取得了重大進展,其中Bai等人報告了對大腦不溶性蛋白質組最全面的分析,涵蓋了AD中的4216個蛋白質和36個DE蛋白質。正如預期的那樣,最豐富的蛋白質是Aβ、tau、APOE和補體成分,以及與β剪接、磷酸化調節、突觸可塑性和線粒體功能有關的蛋白質。令人驚訝的是,整個U1snRNP剪接復合物(例如U1-70K,U1A,U1C,U1snRNA和U1-70K切割片段)存在于不溶性蛋白質組中,并在散發性和家族性AD病例中形成一種新型的細胞質纏繞狀原纖維。結合轉錄學揭示的伴隨的RNA剪接缺陷,這些結果表明U1 snRNP病理及其相關的RNA剪接障礙在AD中存在。人們在細胞培養、蒼蠅和老鼠模型中的進一步研究重將剪接缺陷與阿爾茨海默癥的發病機制聯系起來。
在阿爾茨海默癥中,突觸丟失發生得較早,并且與認知障礙高度相關;因此,科研人員經常研究突觸亞蛋白質組。突觸后密度(PSD)是突觸功能的一個整體結構,由神經遞質受體、支架蛋白和其他調節成分組成的超分子復合物組成。Zhou等人采用超速離心和差異提取的方法從AD患者腦中分離PSD,并用無標記法分析了494個PSD組分。最近,兩個小組利用先進的末端轉移酶方法對突觸亞蛋白質組中的~5000蛋白進行了定量。特別是,Carlyle等人分析了100個AD患者不同疾病階段的大腦,發現認知障礙與顯著的新陳代謝變化和炎癥反應增加有關。
除了亞蛋白質組研究,許多研究試圖表征AD腦中的整個蛋白質組變化,人們分別使用2D Gel或自下而上的MS獲得<1000和1408-6533個蛋白質。例如,Johnson等人對2000多個大腦進行了蛋白質組分析,其網絡分析揭示了大量與AD相關的蛋白質模塊,涉及突觸/神經元、線粒體功能、糖代謝、細胞外基質、細胞骨架和RNA結合/剪接。這些研究還確定了富含神經元、小膠質細胞和星形膠質細胞的蛋白質模塊。2015年,一種先進的LC/LC-MS/MS方法使AD大腦中的>10000蛋白質得以鑒定。人們將這種方法與TMT標記方法相結合,使深層蛋白質組譜分析變得可行。2020年Bai等人提出了這樣一項研究,比較了五組死后腦組織中的14513種蛋白質:(i)低斑塊和纏結的對照組,(ii)高度病理但沒有認知障礙的對照組,(iii)輕度認知障礙(MCI),(iv)高度病理的AD,以及(v)僅有tau病理的進行性核上性麻痹(PSP)。這項研究鑒定了173個DE蛋白,與PSP病例相比其中絕大多數是AD特異性的。根據加權基因相關網絡分析算法,DE蛋白可聚集成三種主要的共表達模式:(I)Aβ相關模式(從對照MCI到AD持續積累),(ii)tau相關模式(從對照到MCI穩定,但在AD中增加),以及(iii)與tau相反的模式(從對照到MCI穩定,但在AD中減少)。交互作用組學和通徑分析揭示了17條改變的途徑,包括Aβ、wnt、轉化生長因子β/骨形態發生蛋白、G蛋白、整合素信號、先天免疫、獲得性免疫、補體、細胞骨架和細胞外基質、鐵穩態、膜轉運、脂質代謝、蛋白質折疊和降解、突觸功能、神經營養功能和線粒體功能。深入的AD蛋白質組學結果表明,在AD進展過程中存在廣泛的、動態的蛋白質組擾動。
到目前為止,三個獨立的小組使用TMT-LC/LC-MS/MS平臺從總共192個AD和對照皮質樣本(圖4)中產生了7個深層蛋白質組數據集(每個都鑒定>
8000個蛋白質)。這些數據集為薈萃分析提供了一個極好的機會來增強統計能力,這些數據匯編成一個包含12017個獨特基因產物的列表(每個基因對應一個蛋白質)。人們通過計算log2(AD/CONTROL)比值和相關的單尾p值,然后用Fisher方法和本杰米尼-霍奇伯格FDR校正進行p值組合,得到2698個DE蛋白(FDR<1%)。根據細胞類型特異性基因圖譜,DE列表包含638個細胞類型特異性基因/蛋白,其中星形膠質細胞140個,神經元337個,少突膠質細胞10個,小膠質細胞118個,內皮細胞33個,這也側面證明了不同細胞類型在AD發病機制中的作用。
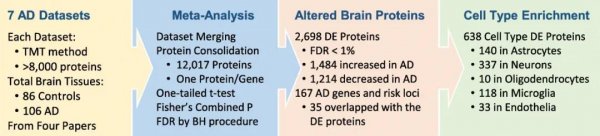
圖4 薈萃分析整合了7個深層AD數據集,鑒定出12017個蛋白質
在每個數據集中,控制-AD比較的p值由單尾t檢驗得出。用Fisher法合并p值,然后用本杰米尼-霍奇伯格FDR程序進行多假設校正。總共有2698個DE蛋白被接受,FDR截止值為1%。與已報道的167個AD基因和危險位點相比,有35個與蛋白質DE列表重疊。根據細胞類型特異性基因,DE列表包含大腦中所有五種主要細胞類型特有的638個基因/蛋白質。
4.AD蛋白質組學的功能觀察
除了概括已知的Aβ、tau和apoE在AD腦中的積累外,蛋白質組學圖譜還顯示了1484個上調的蛋白質和1214個下調的蛋白質(圖4)。有趣的是,DE列表包含35個已報道的AD基因和危險位點,包括APP、MAPT、CLU、APOE、ICA1、PTK2B、CD2AP、SNX32、ADAM17、FERMT2、CARHSP1、ANK3、ABI3、PLEKHA1、BCKDK、GRN、COX7C、TMEM163、CNTNAP2、ADAMTS1、NDUFAF7、SEL1L、RTFDC1。沿著這一思路,人們報道了一項蛋白質組范圍的關聯研究(PWAS),將GWAS數據與腦蛋白質組學結果相結合,以確定11個導致AD的基因。蛋白質組-轉錄組比較表明,在AD中既有RNA依賴的表達變化,也有RNA非依賴的表達變化。值得注意的是,這些不依賴核糖核酸的DE蛋白通常與Aβ水平高度相關,并且富含淀粉樣體,如MDK、PTn、NTN1、SmoC1、SFRP1、SLIT2、HTRA1和Flt1。通過對5xFAD小鼠(一種AD小鼠淀粉樣變性模型)的互補蛋白質組和轉錄分析,驗證了它們的RNA獨立性。Mdk、ntn1和sfrp1也被證明與Aβ肽直接結合。淀粉樣斑塊的大小可達100 μm,這些斑塊巨大的三維復雜性、不同的細胞結構和血管構筑可能會形成一個準細胞的“黑洞”,在其內部捕獲大量的相關蛋白質,從而深刻影響蛋白質的周轉。在淀粉樣體的這些蛋白中,sFRP1(Wnt信號的調節者)被報道影響Aβ寡聚體的形成,因為sFRP1的抑制減少了斑塊的形成,并部分挽救了AD小鼠模型(APP/PS1小鼠)的認知障礙,這佐證了它在AD發病機制中的作用
AD的發展跨越了進行性神經退化之前的一個漫長的前驅階段,這表明人類大腦對Aβ毒性的彈性機制,隨后加劇的損害超過了彈性,并推動了不可逆轉的退化,如平衡模型所示(圖5)。在AD發病之前,一些已鑒定的DE蛋白可能起到保護作用,如Netrin-1、Netrin-3、中期因子、多核營養素、肝細胞生長因子和WNT5B,特別是在表現出高Aβ病理但沒有臨床癥狀的人類恢復力病例中。文獻證據證實了這一評價,例如在腦室注射netrin-1的情況下,netrin-1改善了AD小鼠的工作記憶。Netrin受體UNC5C被鑒定為AD危險基因,另一個netrin家族成員NTN5位于GWAS的AD危險位點。中期因子和多營養素屬于同一家族的軸突生長促進因子,它們與Aβ有高親和力的直接相互作用,可能干擾Aβ的寡聚,降低其毒性。HGF信號的上調可能促進突觸發生,從而補償AD的突觸丟失。此外,WNT途徑被認為可以促進AD風險基因TREM2誘導的小膠質細胞的活性。
圖5 阿爾茨海默癥進展過程中有害因素與保護因素的平衡模型
在阿爾茨海默癥(AD)無癥狀期激活的生物學過程和細胞通路中,有些可能起到保護作用。然而,隨著疾病發展過程中損害的加劇,保護作用也就耗盡了。由此產生的失衡會導致神經元退化和臨床癥狀的出現。途徑信息是從目前的AD蛋白質組學研究中提取的。
從MCI到AD的轉變可能是由有害事件的上調和保護性事件的減少所誘導的,與tau病理的顯著增加相一致的是,MCI向AD的轉變可能是由于有害事件的上調和保護性事件的減少所致。DE列表包含大量的補體蛋白(C1QA、C1QB、C1QC、C1QL1、C1QTNF5、C1R、C1S、C3、C4a和C4b)。補體成分在阿爾茨海默癥(AD)腦中聚集的亞蛋白組中顯著升高。補體系統激活小膠質細胞來修剪AD中的突觸。在大規模的GWAS分析中,補體基因CR1和C7被確定為AD的危險基因。在AD(APP/PS1)小鼠中刪除C3被證明可以挽救突觸丟失和記憶力下降。在肌萎縮側索硬化癥模型(PS19小鼠)中敲除C3aR(C3a受體)也可以減少炎癥、突觸缺陷和tau病理。因此,補體系統影響阿爾茨海默癥進展過程中的多種分子和細胞事件。
相反,許多神經營養因子在從MCI到AD的轉變過程中減少,如VGF、BDNF、NRN1和CRH。值得注意的是,在蛋白質-蛋白質相互作用網絡中,前四種神經營養因子圍繞著BDNF中樞連接在一起。長期以來,BDNF一直被認為是與認知障礙、衰老和AD有關的一個組成部分。人們使用RIMBANET軟件對AD多組學數據集進行多尺度因果網絡分析,將VGF列為主要調節者。VGF在5xFAD小鼠體內的過表達減輕了病理變化,改善了記憶能力。NRN1可以促進軸突生長和突觸成熟,在小鼠模型(Tg2576)中應用重組NRN1蛋白可以改善突觸的可塑性。此外,AMPA型谷氨酸受體結合蛋白NPTX2在AD時明顯降低。在阿爾茨海默癥(APP/PS1)小鼠中,基因敲除會導致GluA4表達減少,神經元興奮性增加。綜上所述,這些關鍵蛋白的減少可能是阿爾茨海默癥突觸衰竭和認知功能障礙的病理生理機制之一。
雖然我們使用一個簡單的平衡模型來討論識鑒定的DE蛋白在AD進展中的作用(圖5),但這些AD相關蛋白的功能在長期的疾病發展過程中很有可能是多因素的,它們是發揮保護作用還是有害作用可能取決于時間、區域和細胞環境。
5. 阿爾茨海默癥中的翻譯后修飾蛋白質組
人體內的蛋白質功能受到無數翻譯后修飾和動態蛋白質-蛋白質相互作用的嚴格調控。在表現為肌萎縮側索硬化癥的神經退行性疾病中,tau纖維在結構上的不同構象可用來劃分疾病亞型。tau聚集與廣泛的PTMS相關,包括磷酸化、泛素化、乙酰化、甲基化、糖基化、叔丁基化、氧化和裂解。對這些疾病特異性tau構象的合理解釋可能隱藏在PTM的領域中。Arakhamia等人利用MS和冷凍電子顯微鏡(Cryo-EM)將PTM映射到tau細絲的結構上,發現tau的泛素化可能有助于纖維多樣性。最近人們從32例AD患者中提取了tau,并對其進行了質譜鑒定和蛋白質聚集活性的表征,研究發現其接種能力與T231、S235和S262位點的磷酸化顯著相關。
眾所周知,tau乙酰化在tau病的早期和中期braak階段升高,并可能減緩tau的降解。K280/K281位點的乙酰化可以促進tau的聚集。tau乙酰化狀態受p300乙酰基轉移酶和SIRT1去乙酰化酶調節。p300活性的化學抑制降低了tau的乙酰化水平,從而消除了與tau相關的病理,表明這可能是緩解 tau 病變的治療策略。
最近,Wesseling等人報道了通過一系列MS策略對AD大腦進行的最全面tau PTM分析。在42例對照組和49例AD患者的多個tau亞型上共鑒定出95個修飾事件(磷酸化55個,泛素化17個,乙酰化19個,甲基化4個)。使用Tau內標,他們還測量了一些PTM位點的化學計量比。PTM事件可能按順序發生,并通過改變表面電荷來促進tau聚集和播種活性。AD患者tau PTM的這些圖譜揭示了分子的異質性和疾病的分期。
Bai等人采用磷酸肽富集和TMT-LC/LC-MS/MS相結合的方法,在AD患者不同時期的腦組織中鑒定出46612個磷酸肽(7083個蛋白中的34173個磷酸位點),揭示了398個蛋白中的873個DE磷酸肽。這項研究還在AD過度磷酸化的tau(56個磷酸化位點)和骨橋蛋白(SPP1)中發現了這兩種蛋白,骨橋蛋白是免疫反應中的一種糖蛋白。有趣的是,IKAP算法用來從磷酸化蛋白質組中推導出186個激酶的活性,表明有28個不同的激酶活性,涵蓋了所有已知的11個tau激酶。激酶活性和水平的整合共同表明AD中MAP激酶信號的激活。使用類似的方法,Ping等人報道了另一個獨立的AD磷酸化蛋白質組的定量數據集(8415個蛋白質中的33652個磷酸位點)。磷酸化蛋白質組在AD發育過程中提供了另一層蛋白質組信息。
此外,人們還報道了AD中蛋白質泛素化的全面分析,覆蓋了1682個蛋白質中的4291個泛素化位點,其中800多個位點在AD中發生了變化。人們還發現特定的多泛素化鏈(Lys11、Lys48和Lys63)在阿爾茨海默病(AD)腦組織中積聚。這些數據表明了AD中泛素系統的失調。蛋白質N-糖基化是細胞中最普遍的PTM之一。Zhang等人對人腦中1132種蛋白質的2294個N-糖基化位點進行了分析,發現了178個與AD相關的N-糖基化位點變化,這表明蛋白質N-糖基化在疾病中發生了異常。綜上所述,目前的質譜平臺和富集策略可以對AD樣本中的PTMS進行集中分析或蛋白質組分析。已經出現了大量的數據集,特別是在磷蛋白質組中。大量的PTM信息也可以在網上獲得(www.philiosite.org),盡管這些數據并不是針對于AD的。綜上所述,這些綜合的PTM數據集對于研究AD發病過程中的生化信號通路將很有價值。
6. 基于蛋白質組學的AD生物標志物發現
基于MS的腦脊液蛋白質組學研究可用于發現生物標志物,目前已經取得了突破性進展。在許多蛋白質組學實驗中,高豐度的蛋白質往往會掩蓋低豐度的蛋白質,因此對這些豐度蛋白質進行免疫耗竭是提高低豐度蛋白質檢測的常用方法。Sathe等人報道了5例對照組和5例AD患者的腦脊液深度研究,他們首先對腦脊液樣本進行免疫去除,去除14種最豐富的蛋白質,然后用TMT-LC/LC-MS/MS方法進行分析。這項研究用139個DE蛋白定量了2327個蛋白,包括MAPT、NPTX2、VGF、GFAP、NCAM1、PKM和YWHAG。Higginbotham等人同時利用免疫去除技術提高了腦脊液蛋白質組的深度,并分析了20例對照組和20例AD患者的2875個蛋白質組,共發現528個DE蛋白,包括MAPT、NEFL、GAP43、FABP3、CHI3L1、NRGN、VGF、GDI1和SMOC1。
Wang等人進行了廣泛的LC分離以繞過免疫耗竭,并分析了5名對照組和8名AD患者中的5941種腦脊液蛋白,這顯著增加了腦脊液蛋白質組的覆蓋范圍。這項研究產生了355個DE蛋白,其中SMOC1和TGFB2蛋白增加,而線粒體蛋白減少。Bader等人開發了一種先進的無標簽平臺,可以對來自三個大小相似的獨立隊列(總計109例對照和88例AD病例)的未耗盡腦脊液樣本進行分析。這項研究分析了三個隊列中的1445、1478和1483種蛋白質,突出了tau、SOD1和Park7這三種DE蛋白質,通過遺傳數據也發現它們與神經退行性變有關。在所有上述研究中,這些結論至少部分得到了基于抗體檢測、靶向MS方法或重復蛋白質組分析的驗證實驗的支持。
人們對以上六個深層腦脊液數據集(每個>FDR 1000蛋白,總計260名AD和對照受試者)進行薈萃分析,得到了5939種蛋白質的列表,其中包括AD中311種上調的蛋白質和165種下調的蛋白質(圖6)。為了加強特定腦脊液生物標志物的選擇,整合腦脊液和腦蛋白質組是一種常用的策略。然后,我們將腦脊液中的這些DE蛋白與腦蛋白質組重疊,得到了65個上調的蛋白質(例如MAPT、SMOC1、HTRA1、PDLIM5、PRDX6、RUVBL2、CALB2、ARFGAP3、SPP1和DPCD)和44個AD下調的蛋白質(例如NPTX2、VGF、PDHA1、NDUFV1、NDUFA2、NDUFA12、NDUFA13)。薈萃分析為將來的驗證提供了AD CSF蛋白質組資源。

圖6 薈萃分析整合了6個深層腦脊液數據集,鑒定出5939個蛋白質
使用圖4中的相同方法計算出用于control-AD比較的單個和組合p值,然后進行FDR分析。在FDR臨界值為1%的情況下,476個DE蛋白被接受,其中109個與AD腦組織中的DE蛋白列表重疊
此外,Wang 等人比較了人類CSF和5xFAD小鼠CSF數據集,指出11種共享DE蛋白(例如SOD2、PRDX3、ALDH6A1、ETFB、HADHA和CYB5R3)可能由淀粉樣變誘導。Higginbotham等人將腦脊液DE蛋白歸納為突觸、血管、髓鞘、免疫和代謝,并應用五個生物標志物將無癥狀AD患者分為兩個亞組。與AD相關病例的異質性一致,轉錄組學和腦脊液蛋白質組學涉及三種分子亞型。
與腦脊液分析相比,AD血漿/血清樣本的深度質譜分析較少,因為由于血腦屏障的原因,大腦中的分子變化可能不容易在血液中檢測到。獨特的血液成分動態范圍也給分析帶來了極大的挑戰,從白蛋白(~50 mg/ml)到白細胞介素-6 (~4.2 pg/ml)。Dey等人報道了用薄層層析和LC/LC-MS/MS對5例對照組和6例AD患者的未耗盡血清進行超深度分析,鑒定出了4826種蛋白質,但仍然缺少豐度最低的蛋白質層(如A-β肽和tau)。然而,重疊的血清、腦脊液和皮質蛋白質組可鑒定出37個DE蛋白,其中包括22個線粒體蛋白,這表明AD患者的線粒體特征是一致的。
細胞外小泡(EV)能夠將腦蛋白輸送到血液中,通過MS分析,這些蛋白可以作為另一類樣本出現。EV是高度異質的納米大小的脂泡,可釋放到細胞外環境以進行細胞交流,它幾乎可由任何類型的細胞分泌,包括神經元、星形膠質細胞和小膠質細胞。EV攜帶和傳播AD相關蛋白,包括APP、Aβ肽和tau。從AD患者和小鼠模型的血漿、腦脊液和腦細胞分離的EV中,Aβ42/Aβ40比值、APP、Aβ單體和寡聚體、tau和tau磷酸化水平均有升高。隨著越來越多的證據表明EV蛋白組分與AD的相關性,我們可以預見更全面的EV蛋白質組學分析用于AD生物標志物的發現。
除了MS對潛在生物標志物的非靶向搜索外,針對腦脊液和血液中的已知病理標志物(例如Aβ和tau)的靶向試驗一直在進行中并取得成功。例如,Aβ和磷酸化tau的腦脊液測試已經被國家老齡研究所和國際阿爾茨海默病新研究標準工作組接受。最近人們對位于T181、T217或T231殘基的pTau進行腦脊液檢測顯示出很高的準確性。這些分析已經進一步擴展到血液測試。基于MS的Aβ多肽(即PreciityAD?)血液檢測試劑盒已經上市,人們還開發了有針對性的質譜方法來評估腦脊液和血液中T217和T181殘留處的pTau水平。pTau數據與淀粉樣蛋白和tau蛋白的PET成像分析以及AD的臨床分期相一致。盡管pTau分析前景看好,但它在血液中的濃度極低(<1pg/ml),需要抗體親和富集或基于抗體的高靈敏度simoA試劑盒。人們需要進一步的獨立和大規模試驗來評估pTau生物標志物的靈敏度和特異性。
7. 基于AD蛋白質組學的系統生物學研究結論與展望
在系統生物學中,生物表型和疾病表型被認為是由空間和時間維度上的成分調節的新興特性,它們的相互作用在結構、分子、細胞
圖通過社區人群隊列研究揭示認知衰退風險因素及其作用機制示意圖在國家自然科學基金項目(批準號:81161120498、82293642、82230043)等資助下,溫州醫科大學/甌江實驗室宋偉宏教授、重......
記憶力衰退,言語令人費解,行為變得怪異,突然發脾氣、摔東西,曾經游刃有余的工作如今變得力不從心,甚至生活難以自理……一些老年人的性格和行為似乎在一夜之間發生了翻天覆地的變化。有科學家認為,這樣的性情大......
河南農業大學食品科學技術學院黃現青教授團隊(食品營養與安全河南省科技創新團隊)在國際著名期刊《Internationaljournalofbiologicalmacromolecules》上發表題為“......
2月4日,全球出版商Wiley對70多個國家近5000名研究人員進行的一項調查顯示,在未來兩年內,在準備論文、撰寫資助申請和同行評議等過程中使用人工智能工具將被廣泛接受。該調查詢問了研究人員目前如何使......
中國科學院腦科學與智能技術卓越創新中心/上海腦科學與類腦研究中心研究員劉真、孫怡迪,博士后朱文成團隊,與復旦大學附屬中山醫院生殖醫學中心主治醫師木良善團隊、上海交通大學醫學院研究員李辰團隊合作,描繪了......
圖FUSEP化學生物學技術用于系統研究賴氨酸和非賴氨酸泛素化的位點信息在國家自然科學基金項目(22137004、22307062)資助下,清華大學藥學院尹航教授團隊在蛋白質泛素化研究領域取得新進展,開......
阿爾茨海默病(AD)是最常見的神經退行性疾病,一旦發病則不可逆轉。1月14日,一項發表在《神經元》雜志上的最新成果,或可為AD治療帶來一種更加有效的新方法。論文通訊作者、深圳理工大學生命健康學院講席教......
以色列耶路撒冷希伯來大學6日發布公報說,該校研究人員發現了阿爾茨海默病與1型單純皰疹病毒之間的聯系。相關論文發表在美國《細胞報告》雜志上。單純皰疹病毒感染是一種常見感染,主要通過皮膚接觸傳播,可引起疼......
葉酸是人體生長發育必需的維生素。由于不能自身合成,人們主要通過飲食攝入葉酸。有效利用基因編輯技術精準調控作物葉酸代謝通路,是農業前沿科學研究的熱點和難點。2024年9月,我國科研團隊在上述問題上取得突......
“盾構機”是隧道挖掘的關鍵設備,曾被國外壟斷多年,每臺的美元售價曾達到以“億”為單位計算的級別。多年來,我國高校科研院所和企業持續攻關,突破了一系列核心技術,成功造出了國產盾構機,售價也降到了每臺不到......